
частиц – слабая кислота НА и ее сопряженное основание А. Выпишем выражение для константы кислотности (3.20) и преобразуем его.
|
|
|
А H |
О |
А = |
К |
а |
НА |
|||||
|
|
Kа = |
|
3 |
|
|
|
|
|
. |
|||
|
|
|
НА |
|
|
|
|||||||
|
|
|
|
H |
О |
||||||||
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
По определению, |
мольная |
|
доля |
кислотной формы равна |
||||||||
НА = |
НА |
, основной – А = |
А |
|
. Запишем уравнение материаль- |
||||||||
|
С |
|
|
|
|
С |
|
|
|
|
|
|
|
ного баланса: С = [A] + [HA]. Проведем необходимые подстановки:
НА = |
НА |
НА |
НА |
|
|
|
|
|
H 3 О |
|
|
||||||||
|
= НА А = |
|
|
|
|
|
|
|
= H О К |
, |
|||||||||
С |
|
|
|
|
К |
|
НА |
||||||||||||
|
|
|
НА H О |
3 |
|
|
|
а |
|||||||||||
|
|
|
|
|
|
|
|
а |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
О |
|
|
|
|
|
|
|
К |
а |
|
|
|||
|
А = 1 – НА = 1 – |
|
3 |
|
|
|
|
|
= |
|
|
|
|
. (3.38) |
|||||
|
H |
О К |
а |
H |
О К |
а |
|||||||||||||
|
|
3 |
|
|
|
|
|
3 |
|
|
|
|
|||||||
Аналогичным образом могут быть выведены формулы для описания более сложных случаев (сосуществование 3 или более сопряженных форм растворенного вещества). Так, состояние двухосновной кислоты (например, сероводорода) описывается следующим образом:
H 2 A = |
|
|
|
|
|
H |
3 |
O 2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
, |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
H |
3 |
O 2 |
K |
a |
1 |
H |
3 |
O K |
a |
1 |
K |
a |
2 |
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
НА = |
|
|
|
|
|
K |
a |
|
H |
3 |
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
, |
(3.39) |
|||||||||||||
H |
3 |
O 2 |
K |
|
H |
3 |
O K |
a |
|
K |
a |
|
|
||||||||||||||||||
|
|
|
|
|
|
a |
1 |
|
|
|
|
|
|
|
|
1 |
|
|
2 |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
K a |
K a |
|
|
K K . |
|
||||||||||||||||||||
А = H O 2 K |
|
|
|
H O |
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
a |
1 |
|
|
|
3 |
|
|
|
|
a |
1 |
|
a |
2 |
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Ионные (распределительные) диаграммы для растворов слабых протолитов строят в координатах i – рН (рис. 3.1, 3.5). Точное построение таких диаграмм возможно при компьютерном расчете мольных долей каждой формы при изменении рН с заданным шагом. Но общий вид ионной диаграммы, особенно для сравнительно простых систем с 2–3 сопряженными формами, можно представить и без такого расчета. Рассмотрим однопротонную систему, например, вод-
131
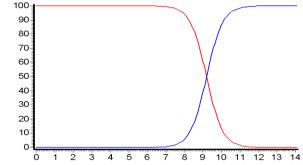
ный раствор аммиака. Из уравнения (3.38) следует, что в сильнокислой среде, где [H+] >> Ka НА ≈ 1, а А ≈ 0. А в сильнощелочной области, где [H+] << Ka , мольные доли составляют: А ≈ 1, HA ≈ 0. Следовательно, при малых рН в растворе доминирует кислотная форма. Кривая, описывающая поведение этой формы, при рН << рKа идет горизонтально на уровне НА ≈ 1. Кривая начинает снижаться лишь за 1–2 единицы до рН = рКа. Когда же величина рН станет на 1–2 единицы больше, чем рКа, эта кривая вновь выйдет на горизонталь, но теперь она пойдет по оси абсцисс ( НА ≈ 0).
|
|
NH4+ |
NH3 |
pH
Рис. 3.5. Ионная диаграмма водного раствора аммиака (pKa = 9,24)
Вторая кривая, описывающая поведение основной формы, идет симметрично первой (рис. 3.5). Из уравнений (3.38) и (3.39) следует, что при рН = рKа мольные доли обеих форм равны, каждая из них равна 0,5. Следовательно, обе кривые должны пересекаться в точке с абсциссой рН = рKа и ординатой = 0,5.
Для многопротонного протолита таким же образом строится участок диаграммы вблизи каждого значения рН = рKаi, описываю-
щего равновесие между двумя сопряженными формами.
Построение ионных диаграмм позволяет понять, что наиболее протонированная форма растворенного вещества доминирует в растворе при рН < pKа1; следующая – при рН от рКа1 до рКа2 и так далее. Наименее протонированная форма А доминирует при рН, превышающем показатель последней константы. Для «промежуточной» по своей протонированности формы растворенного вещества кривая на ионной диаграмме проходит через максимум. Он находится при рН, приблизительно равном полусумме показателей констант, характери-
132

зующих переходы промежуточной формы в более протонированную и менее протонированную. Отметим, что ионная диаграмма, описывающая равновесия протолиза, сохранит свой вид при изменении общей концентрации растворенного вещества.
Пример 3.7. Определить, в каком интервале значений рН в рас-
творе пирофосфорной кислоты (H4P2O7) будут доминировать ионы
HP2O73–.
Решение. Обозначим эту кислоту формулой H4R и найдем в справочниках значения показателей констант кислотности (они совпадают с показателями констант диссоциации). В данном случае рКа1 = 0,91;
рКа2 = 2,10; рКа3 = 6,70; рКа4 = 9,32. Очевидно, в сильнокислой среде,
вплоть до рН 0,91, доминируют молекулы H4R, в зоне рН от 0,91 до 2,10
– анионы H3R–, в зоне рН от 2,10 до 6,70 – ионы H2R2–, в зоне рН от 6,70 до 9,32 – те самые ионы HR3–, о которых идет речь в условии задачи, а в сильнощелочной области при рН > 9,32 доминируют полностью депротонированные ионы R4– . Максимальное значение мольной доли гидро- пирофосфат-анионов будет наблюдаться в середине их зоны доминирования, т. е. при рН = 0,5 ∙ (6,70 + 9,32) = 8,01. Именно это значение рН надо создать в растворе, чтобы перевести любые пирофосфаты, независимо от их начальной протонированности, в форму НР2О73–-ионов. Для решения данной задачи построение ионной диаграммы с помощью соответствующей компьютерной программы не обязательно, но оно подтверждает сделанный вывод (рис. 3.6). Видно, что максимальное содержание ионов HR3– в растворе (при рН 8) составляет около 90 % , т. е. полностью перевести пирофосфорную кислоту в эту форму нельзя.
, %
рН
Рис. 3.6. Состояние пирофосфорной кислоты в водном растворе:
1 – H4R; 2 – H3R– ; 3 – H2R2– ; 4 – HR3–; 5 – R4–
133
Буферные растворы. Такие растворы используют для создания и поддержания необходимого значения рН, не меняющегося при разбавлении раствора и добавлении небольших количеств кислот и оснований. Буферными свойствами не обладают ни чистая вода, ни растворы сильных протолитов (кроме растворов очень высокой концентрации). Так, если к 1 л воды с рН = 7 добавить всего 10–4 моль сильной кислоты, рН раствора составит 4, т. е. изменится на 3 единицы. А если в 10–4 М раствор сильной кислоты ввести 10–3 моль сильного основания, то его рН возрастет примерно до 11.
Буферным называют раствор, который содержит слабую кислоту и ее сопряженное основание, причем их концентрации отли-
чаются не более чем в 10 раз. К числу важнейших, наиболее часто используемых буферных систем, относятся ацетатная (СН3СООН, СН3СОО–), аммиачная (NH3, NH4+), фосфатная (H2PO4–, HPO42–) и др. Для приготовления буферных растворов берут хорошо растворимые, доступные реактивы: слабые кислоты и их соли, слабые основания и их соли, смеси солей многопротонных кислот. Некоторые соли обладают буферным действием и в «индивидуальном» растворе: в ходе протолиза они образуют пару сопряженных протолитов либо изначально содержат ион-амфолит. Примером солей первого типа является тетраборат натрия (бура) Na2B4O7 ·10Н2О. В ее водном растворе идет реакция:
В4О72– + 3Н2О = 2 Н3ВО3 + 2ВО2–.
Примером солей второго типа может быть гидрокарбонат натрия или гидротартрат калия (кислая соль винной кислоты).
Буферные растворы в лаборатории часто готовят путем неполной нейтрализации раствора слабого протолита рассчитанным количеством сильного протолита.
Необходимо уметь подбирать состав буферного раствора, обеспечивающего требуемое для проведения аналитической реакции значение рН, а также рассчитывать рН буферных растворов и предвидеть изменение их рН при добавлении протолитов.
Уравнение для рН буферного раствора легко вывести из выражения (3.20) путем его логарифмирования:
НА |
|
|
А |
[H3O+] = Kа А |
|
; |
рН = рKа + lg НА . |
Присутствие в растворе второго компонента сопряженной протолитической пары подавляет протолиз данного протолита, поэтому
134

без большой погрешности можно приравнять равновесные концентрации слабых кислоты и основания в буферном растворе их аналитическим концентрациям, считая, что [HA] ≈ Cкисл, [A] ≈ Cосн. Тогда можно записать:
рН = рKа + lg |
Сосн |
. |
(3.40) |
|
Скисл |
||||
|
|
|
Полученное уравнение (3.40) (уравнение Гендерсона – Хассельбаха) очень широко применяется химиками, причем не только аналитиками. Оно показывает, какие значения рН могут быть созданы буферным раствором на основе данной протолитической пары.
Поскольку 0,1 ≤ Сосн ≤ 10, величина рН данного буферного раствора
Скисл
должна принадлежать интервалу (рKа ± 1). Это и есть область буферного действия протолитической пары. Для приготовления раствора с данным рН выбирают протолитическую пару, рKа которой отличается от рН не более чем на единицу; затем, пользуясь уравнением (3.40), рассчитывают необходимое соотношение концентраций сопряженных кислоты и основания (пример 3.8).
Объясним механизм буферного действия смеси слабых сопряженных протолитов. Как следует из уравнения (3.40), разбавление такого раствора не должно влиять на его рН. Ведь при разбавлении концентрации кислоты и основания уменьшатся в одинаковое число раз, а отношение их концентраций останется постоянным1. При добавлении сильных протолитов с ними реагирует один из компонентов буферного раствора, в результате чего взамен сильной кислоты в растворе образуется эквивалентное количество слабой кислоты, вместо сильного основания – слабое основание. В этом случае рН меняется, но это изменение незначительно, буферный раствор смягчает действие добавленного протолита. Рассчитать рН образовавшегося раствора можно, используя уравнение (3.40), которое удобно записать не через концентрации, а через количества веществ (компонентов буфера):
рН = рKа + lg |
nосн |
. |
|
nкисл |
|||
|
|
1 Это верно для не слишком разбавленных растворов; сильное разбавление может несколько сместить равновесие за счет побочных процессов.
135

При добавлении n молей сильной кислоты величина рН изменится:
nосн nН О
рН = рKа + lg 3 .
nкисл nН 3 О
При добавлении n молей сильного основания:
рН = рKа + lg nосн nОН . nкисл nОН
Устойчивость величины рН буферного раствора характеризует его буферная емкость – отношение концентрации добавленного сильного протолита к изменению рН в результате добавления этого протолита:
= |
dCOH |
|
dCH3O |
|
|
|
= – |
|
. |
(3.41) |
|
dpH |
dpH |
||||
Знак (–) учитывает уменьшение рН раствора при добавлении кислоты. Физический смысл буферной емкости: она равна числу молей сильного протолита, добавление которого к 1 л буферного раствора приведет к изменению рН на единицу. Расчет буферной емкости проводят по формуле:
= 2,3 |
СкислСосн |
|
Скисл Сосн . |
(3.42) |
Анализ уравнения (3.42) показывает, что буферная емкость максимальна (а значит, рН раствора меняется слабо) при равных концентрациях сопряженных протолитов Скисл=Сосн, при этом рН = рKа. Суммарная концентрация обоих протолитов должна быть достаточно большой. Это учитывают при приготовлении буферных растворов.
Пример 3.8. Найти рН раствора, полученного при смешивании равных объемов 1 М раствора аммиака и 0,75 М раствора сульфата аммония. Как изменится рН при добавлении к 1 л такого раствора 50 мл 0,2 М раствора соляной кислоты?
Решение. Для расчета используем уравнение (3.40). Величина рKа (NH4+) = 14,00 – рKb (NH3) = 14,00 – 4,76 = 9,24. С учетом увеличения объема (вдвое) при смешивании растворов и соответствующего умень-
136

шения концентраций Сосн = 0,5 моль/л, Скисл= С(NH4+) = 2С(NH4)2SO4 =
0,75 моль/л.
рН = рKа + lg |
Сосн |
= 9,24 + lg |
0 ,5 |
= 9,07. |
|
Скисл |
0 ,75 |
||||
|
|
|
1 л такого раствора содержит 0,5 моль NH3 и 0,75 моль NH4+. Добавлено nН = 0,2 · 0,05 = 0,01 моль НСl. Рассчитаем рН получившегося
раствора по уравнению (3.41):
рН = рKа + lg |
nосн n |
Н 3 О |
= 9,24 + lg |
0 ,5 0 ,01 |
|
= 9,05. |
|||
nкисл nН |
О |
0 ,75 |
0 ,01 |
||||||
|
|
|
|||||||
|
|
3 |
|
|
|
|
|
|
|
При добавлении соляной кислоты рН раствора уменьшится незначительно, всего на 0,02 единицы рН.
Пример 3.9. Как приготовить буферный раствор с рН 5,00 и буферной емкостью не менее 1?
Решение. Прежде всего, необходимо подобрать протолитическую пару с рKа 4–6. Подходящей является, например, пара СН3СООH, СН3СОО–, для которой рKа = 4,76. Соотношение концентраций компонентов раствора найдем по уравнению (3.40):
lg Сосн = рН – рKа = 5,00 – 4,76 = 0,24;
Скисл
Сосн = 100,24 = 1,74; Сосн = 1,74 Скисл .
Скисл
Чтобы буферная емкость составила 1, решим неравенство:
= 2,3 |
С |
кисл |
С |
осн |
|
1,74C 2 |
1; |
|
|
0,684 моль/л. |
|
|
= 2,3 |
кисл |
C |
|
|||||
|
|
|
|
|
кисл |
|||||
|
Скисл Сосн |
2,74C |
|
|
|
|||||
|
|
|
|
|
||||||
|
|
|
|
|
|
кисл |
|
|
|
|
Условию удовлетворяет раствор с С(СН3СООH) = 0,684 моль/л и С(СН3СООNa) = 0,684 ∙ 1,74 = 1,19 моль/л, а также более концентриро-
ванные растворы, в которых Сосн = 1,74. Приготовить такие растворы
Скисл
можно, рассчитав и точно измерив объем концентрированной уксусной кислоты и навеску ацетата натрия.
137
3.4. Реакции комплексообразования и их применение в анализе
Общие сведения. Вначале реакции комплексообразования нашли свое применение в качественном анализе – образование или разрушение окрашенных комплексов позволяет обнаружить многие вещества, в частности, катионы переходных металлов (см. раздел 4.1). Позднее некоторые из этих реакций стали использовать и для количественного анализа: малорастворимые комплексные соединения могут быть осаждаемой и даже гравиметрической формой (раздел 4.2). Реакции образования комплексных соединений – основа метода комплексометрии, широко распространенного в практике титриметрического анализа (раздел 4.5). В фотометрическом анализе определяемые вещества переводят в поглощающие свет комплексы, а уже затем измеряют аналитический сигнал (раздел 6.3). Аналогичные реакции позволяют проводить экстракционное разделение и концентрирование микропримесей (раздел 7.2). Наконец, с помощью реакций комплексообразования можно целенаправленно регулировать кислотно-основные или окислительно-восстановительные свойства определяемых веществ.
Строение и состав комплексных соединений впервые были объяснены в рамках координационной теории А. Вернера на рубеже XIX и XX веков. Напомним, что любой комплекс должен включать центральный атом (комплексообразователь) и лиганды (молекулы или анионы). Они связаны ковалентными связями, образованными по донорно-акцепторному механизму. Получающуюся при таком взаимодействии устойчивую заряженную частицу можно рассматривать как внутреннюю сферу комплексного соединения, с которой слабо связаны ионы внешней сферы. Последние имеют заряд, противоположный заряду внутренней сферы, и удерживаются около нее ионными связями. Из раствора кристаллизуются именно такие – нейтральные – комплексные соединения. Примеры – К4[Fe(CN)6] или [Cu(NH3)4]Cl2. Свойства выделенных из раствора нейтральных комплексных соединений изучают специалисты в области неорганической и координационной химии.
Несколько по-другому подходят к комплексообразованию аналитики. Они изучают и применяют реакции между комплексообразо-
138
вателем и лигандами, идущие в растворе. В водном растворе «внутренняя сфера» является самостоятельной частицей, ионы внешней сферы связаны с ней очень слабо, практически не влияя на важные для анализа характеристики. Поэтому аналитики считают комплексными соединениями продукты взаимодействия центрального атома с лигандами, независимо от наличия заряда у образующегося соединения и возможности его препаративного выделения. Соответственно,
комплексом (комплексной частицей) они называют ион или молекулу, в состав которых входят более простые частицы, способные к самостоятельному существованию в растворе (или в составе кристал-
ла). Примерами могут быть анионный комплекс Fe(SCN)63–, нейтральный комплекс FeСl3 или катионный комплекс Cu(NH3)42+. А вот сульфат-анион комплексом не является, так как атомы кислорода и серы в соответствующих степенях окисления не способны к самостоятельному существованию в растворе.
Способность комплексообразователя образовывать определенное число химических связей с лигандами характеризуют его координационным числом. Чаще всего оно равно 4 или 6. В анализе применяют устойчивые комплексные соединения переходных металлов, свинца, олова, алюминия, редкоземельных элементов и т. п. Однако широко используются и такие комплексы, в которых центральным атомом является неметалл (например, As или P).
Число связей, которые единичный лиганд образует с комплексообразователем, называют дентатностью. Неорганические лиганды обычно монодентатны: аммиак, вода, фторид-, хлорид-, цианид-ион и др. Бидентатными лигандами являются некоторые двухзарядные анионы (например, сульфат SO42–), бифункциональные органические соединения (диамины, многие аминокислоты и оксикислоты, оксалат С2О42 и другие анионы двухосновных карбоновых кислот). Существуют и лиганды с более высокой дентатностью, соответствующие органические молекулы содержат 3–6 функциональных групп донорного характера, каждая из которых образует одну связь с центральным атомом. Эти функциональные группы (-ОН, -СООН, -NH2 и некоторые другие) имеют неподеленные электронные пары, обеспечивающие образование связи с комплексообразователем.
Наибольшую практическую значимость имеют такие комплексы, которые содержат один центральный атом, а вся его координационная сфера заполнена одинаковыми лигандами. Однако в анализе применяются и комплексы более сложной структуры. В частности:
139

полиядерные, содержащие несколько комплексообразователей,
смешаннолигандные, содержащие лиганды разного типа,
ненасыщенные, т. е. такие, где часть мест в координационной сфере центрального атома занята молекулами растворителя.
Соотношение между координационным числом комплексооб-
разователя и дентатностью лиганда определяет возможный состав комплекса. Так, катион Al3+ с координационным числом 6 может
присоединить 6 монодентатных лигандов (пример – фторидный ком-
плекс AlF63–), или 3 бидентатных лиганда (оксалатный комплекс Al(С2О4)33–), или 2 тридентатных лиганда. Учитываются и пространственные (стерические) факторы. Так, если молекула монодентатного лиганда очень велика по объему, и несколько таких молекул у одного
итого же комплексообразователя не помещаются, то в координационной сфере центрального атома свободные места занимают молекулы растворителя или какого-либо другого лиганда.
Комплексы с полидентатными лигандами называют хелатами. Разные функциональные группы одного и того же лиганда захватывают центральный атом с разных сторон, как клешня краба (слово «хелат» в переводе с греческого обозначает клешню). Нередко молекула реагента превращается в лиганд, теряя атомы водорода, в этом случае раствор подкисляется. Примером может быть взаимодействие щавелевой кислоты с ионами цинка, в ходе которого образуется оксалатный комплекс:
|
2 H2C2O4 + Zn2+ |
Zn(С2O4)2 2– + 4 H+ |
||||||
|
|
|
|
|
|
|
2– |
|
O = C _________ O |
O _________ C = O |
|||||||
|
||||||||
|
|
|
|
Z n |
|
|
||
O = C |
|
_________ O |
|
|
|
|||
|
O _________ C = O |
|
||||||
|
|
|
|
|
|
|
|
|
Структура оксалатного комплекса цинка(II)
Традиционно используемые структурные формулы комплексных соединений имеют условный характер, на самом деле эти соединения имеют трехмерную, пространственную структуру, которую трудно передать схемой на плоскости.
В структуре хелатов можно выделить циклические группы из нескольких атомов. В цикл входит и центральный атом. Образование
140
