

Числовые значения констант равновесия разного типа приводятся в соответствующих справочниках. А вот константы равновесия окислительно-восстановительных реакций в справочниках не приводятся, их рассчитывают, пользуясь справочными данными по стандартным потенциалам полуреакций (см. раздел 3.6).
Химические равновесия в сложных системах. Условные константы равновесий. Во многих случаях состав анализируемого раствора оказывается настолько сложным, что в нем одновременно могут протекать реакции разных типов, устанавливаться несколько равновесий. Так, участвующие в реакции комплексообразования лиганды одновременно могут проявлять свои кислотно-основные свойства. Катион металла, входящего в состав осадка, может одновременно вступать в реакцию комплексообразования с каким-либо лигандом и т. п. В результате этих взаимодействий в растворе оказывается несколько форм растворенного вещества.
Влияние побочных процессов, конкурирующих с основной аналитической реакцией, учитывают с помощью условных (реальных) констант равновесия. В соответствии с ЗДМ условная константа выражается как соотношение общих концентраций реагентов и продуктов реакции в условиях установившегося равновесия. Каждый сомножитель в выражении условной константы представляет суммарную концентрацию всех форм соответствующего вещества, которые появились в растворе за счет побочных реакций.
Для реакции aA + bB dD + eE
Cd Ce
Кусл = D E . (3.11)
CAa CBb
Можно установить связь между условной и концентрационной константами равновесия. С учетом соотношения (3.1) запишем, что равновесная концентрация той формы вещества А, которая участвует в интересующем нас процессе, из-за некоторого побочного процесса составляет только часть от общей концентрации А в растворе: [A] = ACA. Аналогично [B] = BCB, [D] = DCD и т. п. После несложных алгебраических преобразований получаем:
усл |
|
CDd CEe |
D d E e |
Aa Bb |
|
С Aa Bb |
|
К |
= |
|
= A a B b |
|
= К |
|
. (3.12) |
CAa CBb |
Dd Ee |
Dd Ee |
111
В формулу (3.12) входят обозначаемые символом мольные доли тех форм реагентов, которые принимают участие в основном процессе. Значения вычисляются для заданных условий проведения реакции, при этом используются константы равновесия побочных процессов. Конкретные примеры будут рассмотрены в разделах
3.4 – 3.5.
Побочные процессы с участием исходных веществ приводят к сдвигу соответствующего равновесия влево, к ослаблению основного процесса, поскольку А или В в этом случае оказываются существенно меньше единицы, а Кусл КС. Напротив, побочные реакции с участием продуктов основной реакции приведут к сдвигу равновесия вправо, в сторону более полного протекания основного процесса. В этих случаях Кусл > КС. К тому же результату можно прийти, применяя принцип Ле-Шателье.
Влияние химических факторов (т. е. побочных реакций, меняющих состояние реагентов в растворе) на положение равновесия проявляется в гораздо большей степени, чем влияние электростатического взаимодействия ионов. Если значения КС обычно отличаются от КT в несколько раз, то величина Кусл может отличаться от KC в тысячи и миллионы раз. Поэтому пренебрегать побочными процессами, не учитывать состояние реагентов в растворе нельзя.
3.3. Кислотно-основные процессы
Реакции между кислотами и основаниями широко используются в анализе. На этих реакциях основан самый известный титриметрический метод – метод нейтрализации. Кислотность раствора, характеризуемая величиной рН, – важнейший фактор, влияющий на аналитические реакции любого типа. Например, на скорость и равновесие реакций комплексообразования и окисления-восстановления, на процессы осаждения, экстракции, ионного обмена. Влияние рН раствора особенно важно при разделении и опознании ионов с использованием качественных реакций (см. раздел 4.2), при комплексонометрическом титровании (раздел 4.5), в фотометрическом анализе – при переводе определяемого вещества в окрашенное соединение (раздел 6.3), при экстракционном концентрировании микропримесей (раздел 7.2). В этих и многих других случаях необходимо управлять кислотно-основными процессами в растворах и эффективно исполь-
112
зовать их. Для разработки методик и осознанного проведения качественного и количественного анализа химик должен уметь:
оценивать степень протекания кислотно-основной реакции по величине константы равновесия, с учетом концентрации реагентов;
рассчитывать рН раствора заданного состава и, наоборот, подбирать состав раствора, обеспечивающий заданное значение рН;
определять состояние растворенного вещества при разных рН (строить ионные диаграммы) и рассчитывать мольную долю любой формы этого вещества при заданном рН;
подбирать значение рН, оптимальное для проведения какойлибо аналитической реакции, для перевода реагента в наиболее реакционноспособную форму.
Для решения всех этих задач нужна хорошо разработанная теория кислотно-основных процессов, пригодная как для водных, так
идля неводных растворов.
Теории кислот и оснований. Представления о кислотно-
основных свойствах веществ формировались постепенно, начиная со времен алхимии. В XVII–XIX веках начали складываться первые теории, связывающие кислотно-основные свойства веществ с их составом (Р. Бойль, А.Л. Лавуазье, Г. Дэви, Ж. Гей-Люссак, П. Дюлонг, И.Я. Берцелиус). В настоящее время используются:
теория электролитической диссоциации (С. Аррениус,
В. Оствальд),
протолитическая теория (И. Бренстед, Т. Лоури),
электронная теория (Г. Льюис).
Напомним, что, согласно теории электролитической диссо-
циации, кислотой называют вещество, которое при диссоциации в водном растворе из катионов образует только ионы Н+, основанием – вещество, которое при диссоциации из анионов образует только ионы ОН–. По протолитической теории кислота – это частица (молекула или ион), которая способна отдавать ион Н+ («протон»), основание – частица, принимающая протон. В электронной теории кислота
– это акцептор электронной пары при образовании донорно-акцеп- торной связи, а основание – донор электронной пары.
Естественно, реальные свойства вещества, его способность быть кислотой или основанием, не зависят от того, какую теорию мы выберем. Вещества классифицируют по объективным признакам. Так, к классу кислот относят вещества, определенным образом взаимодействующие с основаниями, металлами, спиртами; вызывающие
113

появление характерной окраски цветных индикаторов и т. п. Любая теория должна согласовываться с фактами, поэтому вещество, проявляющее вышеперечисленные признаки, например СН3СООН в водном растворе, в рамках любой из названных теорий должно считаться кислотой. К сожалению, ни одну из известных теорий нельзя применить для прогнозирования кислотно-основных свойств всех веществ и для любых условий. Каждая теория имеет свои преимущества и ограничения.
Теория электролитической диссоциации, созданная еще в XIX веке и до сих пор используемая электрохимиками и школьными учителями, имеет хорошо разработанный математический аппарат. Но она рассматривает очень узкий круг кислот и оснований (только молекулы и ионные кристаллы типа NаОН). Она неприменима к неводным растворам и процессам, идущим в отсутствие растворителя. А в электронной теории Льюиса, часто используемой химиками-органи- ками, не находят объяснения амфотерные свойства веществ. Теория Льюиса (как и более поздние теории Усановича и Пирсона) рассматривает кислотно-основные процессы слишком обобщенно. Эти теории не дают количественного описания кислотно-основных равновесий, что необходимо для разработки методик анализа.
В аналитической химии наибольшее признание получила протолитическая теория Бренстеда–Лоури. По этой теории кислотные или основные свойства характерны не только для молекул, но и для других частиц, в том числе для ионов. В результате кислотно-основ- ные свойства самых разных веществ описываются одним и тем же способом1. Протолитическая теория позволяет легко рассчитывать кислотность неводных растворов и прогнозировать влияние растворителя. Недостатком этой теории является лишь невозможность объяснить с ее помощью кислотные свойства молекул, не содержащих атомов водорода.
Основные положения протолитической теории. Эта теория предложена практически одновременно (в 1923 г.) И. Бренстедом (Дания) и Т. Лоури (Великобритания), но в дальнейшем развивал ее именно Бренстед, поэтому нередко говорят: «теория Бренстеда». Ос-
1 Заметим, что в теории электролитической диссоциации для объяснения поведения солей потребовалась особая концепция гидролиза. А для объяснения основных свойств аммиака пришлось постулировать образование гидроксида аммония (NH4OH) и его последующую диссоциацию, хотя это соединение так и не было обнаружено в водных растворах аммиака.
114

новной постулат: проявление кислотных или основных свойств како- го-либо вещества требует участия другого вещества, с противоположной функцией. Реакция между ними обязательно включает передачу протонов от кислоты к основанию. В результате реакции об-
разуются новая кислота и новое основание. Такую реакцию называют протолитической. Ее участниками, как уже было сказано, могут быть любые частицы – молекулы и ионы.
Две частицы – кислота НА и основание А, отличающиеся по своему составу на один протон, образуют сопряженную протолитическую пару и могут в рамках теории Бренстеда рассматриваться как две формы одного и того же вещества. В ходе реакции кислотная форма одной сопряженной пары (НА) реагирует с основной формой
(B) другой пары, при этом образуется основание А и кислота НВ. Общая схема протолитической реакции:
H+ |
|
HA + B |
A + HB |
Например: СН3СООH + NH3 СН3СОО– + NH4+ . Протолитическое равновесие может быть смещено в ту или
иную сторону при добавлении посторонних веществ, реагирующих с каким-либо из участников основной реакции. В частности, равновесие смещается при изменении рН раствора.
Частный случай протолитической реакции – протолиз, т. е. взаимодействие частиц растворенного вещества с растворителем. Особую роль в реакциях протолиза играют протоны. Эти заряженные частицы имеют ничтожно малые размеры, а потому обладают сильнейшим электрическим полем. Поэтому изолированный протон Н+ в растворе не существует. Как и другие растворенные частицы, он сольватируется растворителем, образуя ионы H3O+ в воде, СН3СООH2+ в безводной уксусной кислоте и т. д. Перенос протона от кислот к основаниям идет не только при прямом столкновении соответствующих частиц, но и по сложному «эстафетному» механизму, в котором участвуют молекулы растворителя (см. дополнительную литературу). Это объясняет высокую скорость кислотно-основных реакций в растворах.
Поскольку растворитель – активный участник протолитического процесса, от него зависят свойства растворенного вещества. Например, в водном растворе хлороводородная кислота ведет себя как сильная, т. е. полностью и необратимо протолизующаяся кислота:
HCl + H2O Cl– + H3O+ .
115
В среде растворителя, проявляющего кислотные свойства (протогенного), например, в среде ледяной уксусной кислоты, HCl ведет себя как слабая кислота. Протолиз идет обратимо, устанавливается равновесие:
HCl + СН3СООН Cl– + СН3СООH2+ .
Степень протекания этой реакции гораздо меньше единицы.
Таким образом, в рамках теории Бренстеда никакому веществу нельзя приписывать неизменных кислотно-основных характеристик; нельзя, например, считать, что соляная кислота всегда сильная, а уксусная – всегда слабая. Кислотно-основные свойства одного и того же вещества зависят от того, с чем оно реагирует, в каком растворителе это происходит. Можно сформулировать общее правило: чем сильнее выражены кислотные свойства растворителя, тем слабее проявляются в этом растворителе кислотные свойства растворенных веществ и сильнее – их основные свойства. Это правило позво-
ляет целенаправленно регулировать свойства растворенного вещества, подбирая подходящий растворитель.
Если одним из компонентов протолитической пары является сильная кислота, то второй компонент пары не проявляет основных свойств, не влияет на рН раствора. Так, сильной (в водных растворах) кислоте НCl соответствует очень слабое основание – ион Cl–. Этот ион не вступает во взаимодействие с молекулами воды, не может «оторвать» от них протон. Значение рН водного раствора NaCl не зависит от концентрации хлор-ионов, оно определяется другим процессом (автопротолизом растворителя). Однако в безводной СН3СООН HCl – слабая кислота, в этой среде Cl– действительно является основанием, хотя и слабым.
Можно привести еще один пример. Такие водородсодержащие вещества, как метанол (СН3ОH) или аммиак (NH3), в водных растворах не проявляют кислотных свойств, не отдают протон молекулам воды. Зато их сопряженные формы – анионы метилата (СН3О–) или амида (NH2–) в водной среде являются очень сильными основаниями.
Приведенные примеры можно обобщить и сформулировать следующее общее правило: чем более сильной кислотой является одна из сопряженных форм, тем более слабым основанием будет в том же растворителе другая. И наоборот. Это правило позволяет делать прогнозы, полезные для обоснования соответствующих методик анализа. Так, известно, что в водном растворе и уксусная, и борная
116
кислоты являются слабыми, но уксусная все же более сильная, чем борная. Сопряженные формы этих кислот – ацетаты и бораты – являются основаниями. С учетом выведенной закономерности, основные свойства ацетат-иона должны быть выражены намного слабее, чем у борат-иона. Действительно, ацетат-ионы в водном растворе не удается оттитровать какой-либо сильной кислотой, а соли борной кислоты (например, бура) прекрасно титруются.
Протолитические свойства растворителей. Автопротолиз.
Шкала рН. По протолитическим свойствам растворители делят на несколько групп:
апротонные, не содержащие подвижных протонов, малополярные (с очень низкой величиной диэлектрической проницаемости) и не способные к участию в протолитических реакциях. К их числу относятся углеводороды и их галогенпроизводные, например, С6Н6, СCl4, а также CS2 и др.;
протогенные (кислотные), легко отдающие протоны, но спо-
собные и к их присоединению (безводные СН3СООH, НСООH и другие вещества);
протофильные (основные), легко присоединяющие протоны,
но способные и к их отдаче (этилендиамин H2N(СН2)2NH2 и другие амины, амиды, гидразин, жидкий аммиак);
амфипротные, в равной степени способные присоединять и отдавать протоны (спирты).
Иногда выделяет и другие группы растворителей, в частности:
протоноакцепторные, способные только к присоединению протонов (пиридин С5Н5N);
диполярные апротонные (ДАР) – более полярные ( > 15),
чем другие апротонные растворители. Их кислотно-основные свой-
ства слабо выражены. Примеры: ацетон (СН3)2СО, диметилформамид (СН3)2NСНО, диметилсульфоксид (СН3)2SО, ацетонитрил СН3СN.
Всреде растворителей, обладающих протолитическими свойствами (протогенных, протофильных и амфипротных), а также в некоторых диполярных апротонных растворителях происходит автопротолиз – перенос протонов от одних молекул растворителя HL к другим. Схематически процесс автопротолиза можно представить так:
HL + HL H2L+ + L–.
Образующиеся при этом собственные ионы растворителя получили особые названия – лионий (H2L+) и лиат (L–). Равновесие характери-
117
зует константа автопротолиза КHL, постоянная для данного растворителя при данной температуре величина:
КHL = |
a H L+ a L– |
≈ [H2L+] [L–]. |
(3.13) |
|
2 |
|
|
Переход от активностей к концентрациям связан с тем, что в малополярных неводных растворителях коэффициенты активности ионов можно считать равными единице. В справочной литературе приводятся обычно не сами константы автопротолиза, а их показатели (табл. 3.2). Здесь и далее оператор р (показатель) обозначает взятие десятичного логарифма и изменение его знака на противоположный.
Так, pH = – lg [H+], рК = – lgK, рКHL = –lg КHL.
|
|
|
|
Таблица 3.2 |
|
Свойства некоторых растворителей |
|
||||
|
|
|
|
|
|
Растворитель |
Формула |
рКHL |
|
Тип |
|
растворителя |
|||||
|
|
|
|
||
|
|
|
|
|
|
Вода |
Н2О |
14,0 |
81 |
Амфипротный |
|
|
|
|
|
|
|
Этанол |
С2Н5OH |
19,0 |
24,3 |
Амфипротный |
|
|
|
|
|
|
|
Бутанол (третичный) |
(СН3)3СOH |
24,5 |
10,9 |
Амфипротный |
|
|
|
|
|
|
|
Уксусная кислота (безв.) |
СН3СООH |
14,4 |
6,2 |
Протогенный |
|
|
|
|
|
|
|
Этилендиамин |
H2N(СН2)2NH2 |
15,3 |
12,5 |
Протофильный |
|
|
|
|
|
|
|
Ацетонитрил |
СН3СN |
33,3 |
38,0 |
ДАР |
|
|
|
|
|
|
|
Процесс автопротолиза, идущий в водных растворах по уравнению
H2O + H2O H3O+ + ОН– ,
описывает ионное произведение воды Кw = a H3O+ a OH– = 1,0 ∙10–14,
рКw = 14,00 (при 25°С). Коэффициенты активности ионов гидроксония и гидроксила могут существенно отличаться от единицы; это надо учитывать при значительной ионной силе раствора. Однако в большинстве случаев высокая точность расчетов не требуется, и при описании кислотно-основных процесссов принимают:
Кw = [H3O+][OH–]. |
(3.14) |
118

Кислотность растворов принято описывать с помощью введенного С. Серенсеном водородного показателя (рН). Для водной среды
рН = – lg a H O+. |
(3.15) |
3 |
|
Часто принимают, что ≈ [H3O+], и рассчитывают рН вод-
ного раствора по приближенной формуле: рН = – lg [H3O+]. Для произвольного протолитического растворителя определяют рН раствора по обобщенной формуле:
рН = – lg [H2L+]. |
(3.16) |
Величину рН раствора можно определить опытным путем, обычно используют потенциометрический метод (разд. 6.1.2). Однако, зная состав раствора, его рН можно предвидеть. Проще всего рассчитать рН растворов сильных кислот и оснований, сложнее – растворов слабых протолитов, еще труднее – pH смеси нескольких протолитов разной силы.
Характер среды (кислая, щелочная или нейтральная) определяется соотношением между равновесными концентрациями лиония и лиата. В кислой среде концентрация лиония выше, чем концентрация лиата; в щелочной, наоборот, концентрация лиата выше, чем концентрация лиония; в нейтральной среде эти концентрации равны.
В чистом растворителе и в растворах веществ, не обладающих протолитическими свойствами, [H2L+] = [L–] = 
 KHL . После лога-
KHL . После лога-
рифмирования получаем: рН = рКHL / 2. Это выражение характеризует нейтральную среду, независимо от природы растворителя. В ней-
тральном водном растворе [H3O+] = [OH–] = 
 Кw = 1,0 ∙10–7 моль/л, откуда рН = pKw2 = 7,00 (при 298 К). В растворах кислот в результате протолиза повышается концентрация ионов лиония (для водных растворов – гидроксония). В этом случае [H2L+] >
Кw = 1,0 ∙10–7 моль/л, откуда рН = pKw2 = 7,00 (при 298 К). В растворах кислот в результате протолиза повышается концентрация ионов лиония (для водных растворов – гидроксония). В этом случае [H2L+] > 
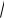 KHL , а рН < рКHL/2.
KHL , а рН < рКHL/2.
В водных растворах кислот [H3O+] > 
 Кw и рН < 7. В растворах
Кw и рН < 7. В растворах
оснований, напротив, рH > рКHL/2, в частности, в водных растворах оснований рН > 7.
Границами шкалы рН в любом протолитическом растворителе считают значения рН, соответствующие 1 М растворам лиония и лиата, т. е. рН, равные 0 и рКHL. В частности, при 298 К в водных растворах 1 М раствор сильной кислоты дает (без учета ионной силы) рН = 0, а 1 М раствор сильного основания рН = 14.
119

|
кислая среда |
|
|
щелочная среда |
|
|
|
(а) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
7 |
14 |
|||||
|
нейтральная среда |
|
|
|
|||
|
кислая среда |
|
|
щелочная среда |
|
|
|
(б) |
|
|
|
|
|
|
|
|
рКHL/2 |
рКHL |
|||||
0 |
|||||||
нейтральная среда
Рис. 3.3. Шкала рН в воде (а)
и в произвольном протолитическом растворителе (б)
При повышении температуры автопротолиз усиливается, КHL растет, поэтому границы шкалы и точка нейтральности смещаются. Так, при 100 °С рКw = 12,26, поэтому рН нейтрального водного раствора при этой температуре равен не 7,00, а 6,13.
Одно и то же числовое значение рН в разных растворителях может соответствовать разным средам. Так, рН = 9,5 в водном растворе – это слабощелочная среда, но в среде этанола (рКHL = 19) – это нейтральная среда, а в среде бутанола (рКHL = 24,5) – кислая. Стоит обратить внимание, что шкала рН для большинства неводных протолитических растворителей длиннее, чем в случае водных растворов. Это способствует раздельному титрованию нескольких кислот (или нескольких оснований) в неводных растворах.
Расчет рН растворов сильных протолитов. Введем следую-
щие допущения:
в растворе содержится только одно вещество, способное к протолизу;
частица такого вещества присоединяет или отдает только один протон;
протолиз идет необратимо и количественно (на 100 %);
влиянием ионной силы раствора можно пренебречь;
концентрация протолита достаточно высока по сравнению с
концентрацией продуктов автопротолиза. Этому условию соответствуют водные растворы, если С > 10–5 М.
При выполнении всех перечисленных условий по исходной (аналитической) молярной концентрации растворенного вещества С
120
