
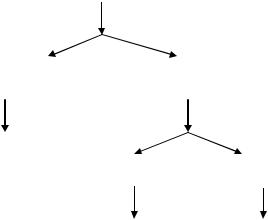
После отделения какой-либо группы ионов полученный осадок растворяют (обычно в кислоте) и исследуют состав полученного раствора дробным методом, применяя селективные реагенты, прежде всего органические. В некоторых случаях найти их не удается, тогда раствор, содержащий катионы одной аналитической группы, разделяют далее, выделяя подгруппы ионов. Так, осадок сульфидов катионов 3-й группы действием (NH4)2S2 делят на подгруппы меди и мышьяка. А осадок карбонатов катионов 2-й группы растворяют в уксусной кислоте, а затем последовательно разделяют смесь этих катионов (рис. 4.2).
Раствор Ca2+, Sr2+, Ba2+
+ К2CrO4 |
|
|
Отделение осадка |
Раствор |
|
BaCrO4 |
Ca2+, Sr2+ |
|
|
+ (NH4)2SO4 |
|
Растворение осадка |
|
|
и обнаружение Ba2+ |
|
Раствор |
Отделение осадка |
||
SrSO4 |
|
Ca2+ |
|
+(NH4)2C2O4 |
Обнаружение Sr2+ |
Обнаружение Сa2+ |
Рис. 4.2. Ход разделения смеси катионов второй группы
Кислотно-щелочная схема систематического анализа смеси катионов разработана менее детально и рассчитана на обнаружение меньшего числа ионов. Преимущества этой схемы – использование таких важных свойств неорганических соединений, как кислотноосновные свойства, амфотерность. Отнесение катионов к той или иной группе здесь также связано с электронной конфигурацией ионов и положением соответствующих элементов в таблице Менделеева (табл. 4.3). Но главное – метод не требует применения ядовитого сероводорода.
201

|
|
|
|
|
|
|
|
|
Таблица 4.3 |
||
|
|
Аналитическая классификация катионов |
|
|
|||||||
|
|
|
|
по кислотно-щелочному методу |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
Группа |
|
Катионы |
|
|
Групповой |
Действие |
|
|
|||
|
|
|
реагент |
группового реагента |
|
||||||
|
|
|
|
|
|
|
|
||||
1 |
NH4+, Na+, K+ |
|
––– |
––– |
|
|
|||||
2 |
Pb2+, Ag+, Hg 2 |
HCl (2 М) |
Образует осадки хлоридов |
||||||||
|
|
|
|
|
2 |
|
|
PbCl2, AgCl, Hg2Cl2 |
|
||
|
|
|
|
|
|
|
|
|
|||
3 |
Ba2+, Ca2+, Sr2+ |
H2SO4 (1 М) |
Образует осадки сульфатов |
||||||||
|
|
|
|
|
|
|
|
MeSO4 |
|
|
|
|
|
|
|
|
|
|
|
Первоначально образовавшиеся |
|||
|
Al3+, Cr3+, Zn2+, |
NaOH или |
осадки гидроксидов растворя- |
||||||||
4 |
Sn |
2+ |
IV |
III |
, |
KOH (избы- |
ются в избытке реагента, обра- |
||||
|
, Sn , As |
|
ток 2 М |
– |
|
– |
, |
||||
|
|
|
As |
V |
|
|
зуя [Al(OH)4] |
, [Cr(OH)4] |
|||
|
|
|
|
|
|
раствора) |
[Zn(OH)4]2– , [Sn(OH)3]–, |
|
|||
|
|
|
|
|
|
|
|
[Sn(OH)6]2– и др. |
|
||
|
|
|
|
||||||||
|
Fe3+, Fe2+, Mg2+, |
NaOH или |
Образует осадки гидроксидов, |
||||||||
5 |
Mn2+, Bi3+, Sb3+, |
KOH (2 М, |
нерастворимые в избытке реа- |
||||||||
|
|
|
SbV |
|
|
избыток) |
гента: Fe(OH)3, Fe(OH)2, |
|
|||
|
|
|
|
|
|
|
|
Mg(OH)2, Mn(OH)2 |
и др. |
|
|
|
|
|
|
|
|
|
NH3 (избы- |
Образуются осадки гидрокси- |
|||
|
Cu2+, Co2+, Ni2+, |
дов, затем они растворяются |
|||||||||
6 |
|
Hg2+, Cd2+ |
|
|
ток 25 % |
в избытке NH3, образуя |
|
||||
|
|
|
|
|
|
|
раствора) |
комплексы [Ме(NH3)4]2+ |
|
||
Кислотно-щелочная схема, как и сероводородная, не свободна от ошибок, вызванных неполным осаждением и соосаждением. Так, ионы Ca2+ осаждаются серной кислотой не количественно, оставшиеся в растворе ионы мешают последующему отделению других групп (см. рис. 4.3) и обнаружению других катионов. Выбор серной кислоты в качестве группового реагента вообще не очень удачен, так как осадок сульфатов щелочноземельных металлов очень трудно перевести в раствор для обнаружения отдельных ионов 3-й группы. Осадок приходится кипятить с насыщенным раствором Na2CO3, сульфаты при этом переходят в карбонаты, которые затем растворяют в кислоте. Вся эта операция («содовая вытяжка») длительна и трудоемка. Катионы 1-й аналитической группы, остающиеся до конца анализа в
202
растворе, трудно открыть из-за значительного разбавления раствора в ходе анализа. Кроме того, их обнаружение в остающемся растворе теряет смысл, поскольку в ходе анализа добавляются реактивы, содержащие некоторые из этих катионов. Поэтому катионы 1-й группы обычно открывают вне схемы систематического анализа, из отдельных небольших порций анализируемого раствора, т. е. дробным методом. Мешающее влияние катионов других групп устраняют, заранее осаждая их (в виде карбонатов, гидроксокарбонатов, гидроксидов) действием карбонатов натрия или калия.
Обнаружение анионов. Анионный состав материалов не столь разнообразен, как катионный. Поэтому систематический анализ смесей анионов с выделением групп и подгрупп обычно не проводят. Групповые реагенты (BaCl2 и AgNO3) нужны лишь для выяснения, анионы каких групп присутствуют в пробе. К первой группе относят
анионы SO42–, SO32–, S2O32–, CO32–, B4O72–, PO43– и другие, осаждаемые катионами бария. Если при добавлении BaCl2 в нейтральной или
слабощелочной среде осадок не образуется, все перечисленные анионы считают не обнаруженными. Ко второй группе относят анионы Cl–, Br-, I–, BrO3–, CN–, SCN–, S2–, осаждаемые AgNO3 в азотнокислой среде. К третьей – анионы NO3–, NO2–, CH3COO– , не осаждаемые ни солями серебра, ни солями бария. Отдельные анионы открывают дробным методом, создавая условия для предотвращения влияния других ионов. Если этому мешают катионы металлов, их заранее удаляют путем ионного обмена (см. главу 7). При пропускании раствора пробы через колонку с катионитом в Н+-форме катионы металлов поглощаются, а в раствор поступает эквивалентное количество катионов H+, не мешающих открытию анионов.
Еще до поиска отдельных анионов проверяют рН раствора пробы, а также проводят испытания на присутствие окислителей (реактив – KI + крахмал) и восстановителей (реактив – KMnO4). Если известно, что проба не содержит ни окислителей, ни восстановителей, ее качественный анализ значительно упрощается. То же происходит и в том случае, когда уже выяснен катионный состав пробы – тогда при поиске анионов можно учесть растворимость соответствующих солей.
203

Раствор катионов |
|
|
1–6-й групп |
|
|
+HCl |
|
|
Осадок хлоридов |
Раствор катионов |
|
катионов |
1, 3–6-й групп |
|
2-й группы |
+H2SO4 |
|
|
|
|
Осадок сульфатов |
|
Раствор катионов |
катионов |
|
1, 4-6-й групп |
3-й группы |
|
+ NaOH |
|
|
|
|
|
(избыток) |
Осадок гидроксидов |
Раствор катионов |
|
катионов 5, 6-й групп |
1-й группы |
|
|
+ HNO3 |
и гидроксокомплексов |
|
катионов 4-й группы |
|
|
(избыток) |
|
|
|
|
Раствор катионов |
|
|
|
5, 6-й групп |
|
|
+ NH3 |
|
|
(избыток) |
|
Осадок гидроксидов |
Раствор аммиачных комплексов |
|
катионов 5-й группы |
|
катионов 6-й группы |
Рис. 4.3. Общая схема систематического анализа смеси катионов по кислотно-щелочному методу
204
4.2. Гравиметрический анализ
История и принцип метода. Гравиметрия – классический метод количественного химического анализа, который используется с давних времен. До середины XX века его называли весовым анализом, поскольку метод основан на взвешивании. Аналитическим сигналом в этом методе является масса вещества, как правило – масса некоторого продукта химической реакции.
Р. Бойль в конце XVII века стал разделять исследуемые вещества до далее не разложимых составных частей (он называл их элементами), а затем взвешивал их. По результатам взвешивания можно было рассчитать относительное содержание элемента в исходной пробе. Например, содержание золота или воды, которую Бойль тоже считал элементом. Но такой вариант весового анализа (метод выделения) возможен далеко не всегда. В конце XVIII века были разработаны другие варианты – метод осаждения (его создал шведский ученый Т. Бергман для анализа минералов) и метод отгонки, предложенный знаменитым французским химиком А. Лавуазье для анализа органических веществ. В обоих случаях искомый элемент выделяли и взвешивали не в свободном виде, а в виде некоторого соединения точно известного состава.
В начальный период развития химии гравиметрия была основным способом количественного анализа. Именно гравиметрическим методом химики получали экспериментальные данные, на основании которых на рубеже XVIII и XIX веков были созданы основные законы химии. В частности, закон сохранения суммарной массы веществ в ходе химических реакций (А. Лавуазье), закон эквивалентов (И. Рихтер), закон постоянства состава (Ж. Пруст) и другие. Результаты огромного множества анализов, выполненных гравиметрическим методом, позволили установить количественный состав и химические формулы всевозможных веществ, а также определить атомные массы большинства элементов (Й.Я. Берцелиус). Гравиметрию использовали и в качестве способа аналитического контроля в промышленности, хотя такому ее применению всегда мешала длительность и трудоемкость соответствующих методик анализа.
Еще в первой половине XIX века развитие теоретических основ и техники гравиметрического анализа привело к значительному повышению его точности. Этому также способствовало совершенствование аналитических весов. Абсолютная погрешность взвешивания
205
снизилась до 0,0001 г, а в отдельных случаях – еще на 1–2 порядка. В настоящее время гравиметрия является одним из самых точных (правильных и воспроизводимых) методов количественного анализа. Нередко относительная погрешность результата гравиметрического анализа не больше 0,01 %. Предотвратить систематические погрешности помогает хорошо развитая теория этого метода.
Гравиметрия – универсальный метод, пригодный и для элементного, и для молекулярного, и для фазового анализа. Но практическое применение гравиметрии в настоящее время сократилось. Теперь так проводят анализ, если необходима высокая точность результатов, а длительность и трудоемкость методик не имеют принципиального значения. Гравиметрию используют для точного определения основных компонентов и важнейших примесей (> 0,1 %) в минералах, почвах, органических веществах, нефтепродуктах, химических реактивах и других объектах. Гравиметрическим методом выполняют особо ответственные анализы (арбитраж, определение драгоценных металлов), определяют состав стандартных образцов химического состава (см. раздел 2.4), стандартизуют исходные растворы для других, менее точных методов (титриметрия, фотометрия) или в ходе научных исследований.
Существуют три основных варианта гравиметрии: методы выделения, методы отгонки и методы осаждения. Последняя группа методов имеет наибольшую практическую значимость.
Методы выделения и методы отгонки. В методах выделения
пробу переводят в раствор, из которого выделяют определяемый элемент в свободном виде, в виде осадка простого вещества. Примером может быть методика анализа горных пород, в которой золото переводят в солянокислый раствор (там оно существует в форме [AuCl4]–), а затем восстанавливают:
2[AuCl4]– + 3H2O2 = 2Au↓ + 3O2↑ + 8Cl– + 6H+.
Осадок отфильтровывают, высушивают и взвешивают.
Другой пример – определение серебра, меди и некоторых других металлов. Их соединения восстанавливают электрическим током на платиновом катоде: Cu2+ + 2e = Cu. Этот вариант гравиметрии,
получивший особое название – электрогравиметрический анализ,
подробно рассмотрен в разделе 6.1.
Методы отгонки включают термообработку пробы и/или обработку ее кислотами. Определяемый компонент превращается в ка-
206
кое-либо летучее соединение (химическая реакция в данном случае не обязательна). В прямых методах массу этого соединения находят по привесу сосуда, содержащего поглотитель, т. е. реагент, взаимодействующий с улавливаемым летучим соединением. Так, для определения карбонатов их переводят в углекислый газ, который отгоняют, а затем поглощают натронной известью (смесь NaOH и CaO). Прямые методы применяют также при определении фтора, мышьяка и некоторых других элементов. Тот же принцип лежит в основе важнейшего метода элементного анализа органических соединений, так называемого СН-анализа. Навеску вещества сжигают в токе кислорода (иногда с добавкой других окислителей и специальных катализаторов). Продукты сгорания поступают в последовательно расположенные поглотительные трубки. В одной из них количественно и селективно поглощается образовавшийся углекислый газ. В другой, содержащей Mg(ClO4)2, поглощается вода. Массу углерода и водорода в исходной навеске рассчитывают по привесу соответствующих поглотителей.
Косвенные методы основаны на измерении убыли массы пробы после отгонки летучего компонента. Например, взвешивая пробу до и после нагревания при определенной температуре, определяют влажность почвы, кристаллизационную воду в кристаллогидратах, фракционный состав или зольность нефти.
Методы осаждения. В этом случае методика анализа включает следующие операции:
взвешивание пробы (взятие навески);
растворение навески;
добавление избытка осадителя (получение осаждаемой формы определяемого вещества);
промывание и фильтрование полученного осадка;
высушивание или прокаливание этого осадка (перевод ана-
лита в гравиметрическую форму);
взвешивание гравиметрической формы.
Выполнение всех операций должно обеспечивать количественное (т. е. не сопровождающееся потерями) превращение определяемого компонента в гравиметрическую форму. Полноту осаждения Х и полноту удаления примесей из осадка при его промывании проверяют с помощью подходящих качественных реакций. Промытый на фильтре осадок высушивают или прокаливают вместе с фильтром до тех пор, пока масса не перестанет уменьшаться. Доведение до постоянной массы свидетельствует о полном удалении воды и летучих
207

примесей, а в случае прокаливания – о полноте сгорания фильтра и полноте перевода Х в гравиметрическую форму.
Гравиметрическое определение некоторых ионов можно представить такими схемами:
+ NH3 |
|
t |
Fe3+ |
Fe(OH)3 |
Fe2O3 |
+ BaCl2 |
|
t |
SO42– |
BaSO4 |
BaSO4 |
+ NH4H2PO4 |
|
t |
Mg2+ |
NH4MgPO4 |
Mg2P2O7 |
определяемый |
осаждаемая |
гравиметрическая |
компонент |
форма |
форма |
Расчет результата анализа. Аналитический сигнал в гравиметрии – это измеренная на аналитических весах масса получаемой в ходе данного анализа гравиметрической формы определяемого вещества – m(ГФ). Независимо от того, какой вариант анализа используют в том или ином случае, результаты рассчитывают с помощью гравиметрического фактора F. Это масса определяемого вещества, точно соответствующая одному грамму гравиметрической формы. Если молярная масса гравиметрической формы равна М(ГФ), а определяемого вещества – М(Х), то величину F рассчитывают по формуле:
F |
M (X) |
|
a |
. |
(4.3) |
|
|
||||
|
M (ГФ) b |
|
|||
При этом учитывают стехиометрию реакции осаждении. Берут такие коэффициенты a и b, чтобы уравнять количества атомов элемента Х в определяемом веществе и в гравиметрической форме. Например, при определении железа в виде Fe2O3 гравиметрический фактор равен:
F (Fe/Fe O ) |
2M (Fe) |
= |
2 55,847 |
0,6994. |
|
|
|
||||
2 |
3 |
M (Fe2O3 ) |
159,69 |
|
|
|
|
|
|||
Точность вычисления величины F и результата анализа должна соответствовать точности взвешивания, поэтому расчет ведут с использованием как можно более точных значений молярных масс. Их выражают числами, содержащими не менее четырех значащих цифр. Такой же должна быть и величина F. Для распространенных методик гравиметрического анализа величину фактора F можно найти в справочниках.
208
Зная F, можно рассчитать результат анализа – массовую долю определяемого компонента Х в анализируемой пробе – по формуле:
х |
mx |
|
m ГФ F |
. |
(4.4) |
|
mпробы |
mпробы |
|||||
|
|
|
|
Выбор осадителя. Реагенты-осадители выбирают с учетом свойств определяемого вещества и состава пробы. Учитывают также свойства осаждаемой и гравиметрической форм, которые можно получить с применением каждого возможного осадителя.
Требования к осаждаемой форме.
1.Селективность действия осадителя. Если это требование не выполняется, т. е. в осадок может перейти не только определяемый компонент, но и другие компоненты пробы, то для получения правильного результата анализа придется маскировать либо предварительно удалять мешающие вещества, а также регулировать величину рН в процессе осаждения.
2.Полнота осаждения. Допустимая концентрация Х в растворе над осадком должна быть не более 10–6 моль/л. В этом случае потери Х за счет неполного осаждения не превысят 0,0002 г – обычную погрешность взвешивания на аналитических весах. Столь малыми потерями
можно пренебречь. Если осаждаемая форма – ионный осадок бинарного типа, а избыточная концентрация осадителя взята на уровне 10–2 моль/л, то осаждаемая форма должна отвечать условию ПР < 10–8. Для осадков более сложного состава ПР должно быть еще ниже.
3.Быстрое отделение осадка от раствора. Осадки легко фильтруются, если они образуются в крупнокристаллической форме. Аморфные осадки также стараются получить в плотной, компактной форме. Для образования осадков с такими свойствами необходимо создавать специальные условия их получения.
4.Осадок должен быть чистым, т. е. не должен содержать никаких примесей, либо примеси должны легко удаляться при промывании и прокаливании. Основной примесью обычно является избыточный осадитель, поэтому в качестве осадителей следует использовать те соединения, которые при прокаливании легко разлагаются
иполностью удаляются.
5.Осадок должен количественно, без потерь, превращаться в гравиметрическую форму постоянного состава. Поэтому нельзя применять осадки, вступающие в химические реакции с углеродом, образующимся при обугливании бумажного фильтра в ходе прокали-
209
вания осадка. Фильтрование, промывание и прокаливание осадков с сильными окислительными свойствами проводят с использованием стеклянных фильтрующих тиглей.
Требования к гравиметрической форме.
1.Постоянный состав, строго соответствующий определенной химической формуле. Так, в качестве гравиметрической формы не могут быть использованы гидроксиды металлов, содержащие неопределенное количество воды, и другие соединения переменного состава.
2.Химическая устойчивость по отношению к кислороду воздуха и водяным парам. Если гравиметрическая форма не отвечает этому требованию (например, CaO), ее взвешивают в плотно закрытом тигле, а охлаждают в эксикаторе, содержащем вещества, поглощающие воду.
3.Как можно большая величина молярной массы (т. е. как можно меньшая величина гравиметрического фактора F). В этом случае погрешность результата анализа уменьшится. Например, определять фосфор можно, получая разные гравиметрические формы:
Mg2P2O7 (F = 0,2783) или (NH4)3PO4 · 12МоО3 (F = 0,01639). При оди-
наковой погрешности взвешивания погрешность определения фосфора по второй методике окажется в 17 раз меньше, чем по первой.
Понятно, почему в качестве осадителей часто используют органические вещества с большой молярной массой (табл. 4.4). Этот способ дает весьма чистые крупнокристаллические осадки. Органические осадители к тому же более селективны, чем неорганические.
|
|
|
Таблица 4.4 |
Примеры гравиметрических определений |
|||
|
|
|
|
Осадитель |
Определяемые |
Осаждаемая |
Гравиметри- |
|
вещества |
форма |
ческая форма |
NH3 (водн.) |
Fe3+, Al3+, SnIV |
MxOy · nH2O |
MxOy |
H2SO4 |
Ba2+, Pb2+, Sr2+ |
MSO4 |
MSO4 |
HCl |
Ag+ |
AgCl |
AgCl |
(NH4)2С2O4 |
Са2+ |
СаС2O4 · H2O |
СаO |
(NH4)2HPO4 |
Mg2+, Zn2+, Mn2+, Cd2+ |
NH4MPO4 · nH2O |
M2P2O7 |
тетрафенилборат |
NH4+, K+, Rb+, |
(С6Н5)4BM |
(С6Н5)4BM |
натрия (С6Н5)4BNa |
Cs+, Ag+ |
|
|
8-оксихинолин (HR) |
Mg2+, Co2+, Zn2+, |
MR2 или MR3 |
MR2 или MR3 |
|
Mn2+, Al3+, Fe3+, In3+ |
||
|
|
|
|
210
