
- •Раздел 1
- •Занятие 1
- •Цель занятия
- •Карбонаты щелочных металлов
- •Отделение ионов аммония
- •Действие щелочей и аммиака
- •Оксалат аммония
- •Родизонат натрия (или калия)
- •Занятие 2
- •Цель занятия
- •1. На чем основано разделение катионов согласно кислотно-основной классификации?
- •2. В какой строке перечислены все групповые реагенты, используемые в кислотно-основной схеме анализа?
- •Цель занятия
- •Цель занятия
- •Салициловая кислота (сульфосалициловая кислота)
- •Цель занятия
- •1. В растворе присутствуют hCl (0,1 моль/л) и h3bo3 (0,01 моль/л). Что можно сказать о рН данного раствора?
- •Действие щелочей
- •Действие щелочей
- •Действие щелочей
- •Гексацианоферрат (II) калия
- •Цель занятия
- •1. Что из перечисленного ниже верно? Гидроксиды алюминия, цинка, хрома (III) растворимы в:
- •5. Найдите ряд, в котором содержится больше всего катионов, выпадающих в осадок в виде гидроксидов и оксосолей при обработке анализируемого раствора избытком 6 м NaOh и 6 м nh3.
- •Цель занятия
- •5. Обнаружение анионов scn- и I-
- •Цель занятия
- •Занятие 9
- •Цель занятия
- •1. В насыщенном водном растворе какого из перечисленных ниже веществ равновесная концентрация ионов металла будет наименьшей (в скобках приведены значения ks)?
- •Занятие 10
- •Цель занятия
- •1. Какие из перечисленных ниже процессов невозможны (дайте ответ, не проводя расчётов)?
- •2. Какая из частиц, выделенных полужирным шрифтом, является самым сильным окислителем?
- •3. Какая из частиц, выделенных полужирным шрифтом, является самым сильным восстановителем?
- •7. Какой из малорастворимых электролитов, формулы которых приведены ниже, обладает самым малым произведением растворимости?
- •9. Вывод об отсутствии какого ряда анионов можно сделать, если известно, что при добавлении к анализируемому раствору разбавленного раствора сильной кислоты не происходит выделения пузырьков газа?
- •10. При добавлении к анализируемому раствору ki в кислой среде не происходит появления бурой окраски вследствие выделения иода. Все анионы какого ряда можно не искать при дальнейшем анализе?
- •Занятие 11
- •Цель занятия
- •Предварительные испытания
- •Занятие 12
- •Цель занятия
- •4. Какой из приведенных ниже графиков отражает зависимость константы распределения предельных монокарбоновых кислот между хлороформом и водой в зависимости от числа атомов углерода в молекуле кислоты?
- •2. Экстракция диметилглиоксиматов никеля и кобальта
- •3. Экстракция соединения комплексного аниона [SbCl6]- с малахитовым зеленым
- •4. Экстракционное разделение I- и Br-
- •5. Экстракция ионного ассоциата берберина с трихлорацетат-анионом
- •6. Экстракция ионного ассоциата димедрола с метиловым оранжевым
- •Раздел 2
1. В растворе присутствуют hCl (0,1 моль/л) и h3bo3 (0,01 моль/л). Что можно сказать о рН данного раствора?
он будет примерно таким же, как и у 0,1 М HCl;
он будет примерно таким же, как и у 0,01 М H3BO3;
его величина будет равна среднему арифметическому рН 0,1 М HCl и 0,01 М H3BO3;
его величина будет равна среднему геометрическому рН 0,1 М HCl и 0,01 М H3BO3;
его величина будет равна сумме рН 0,1 М HCl и 0,01 М H3BO3.
2. Какие из перечисленных соединений не ведут себя по отношению к воде как амфолиты
1) CH3COOK; 2) Na2S; 3) KH2PO4; 4) NH4CN; 5) NH4SCN.
3. Как зависит равновесная концентрация бензоат-иона в 0,01 М водном растворе бензойной кислоты от рН?
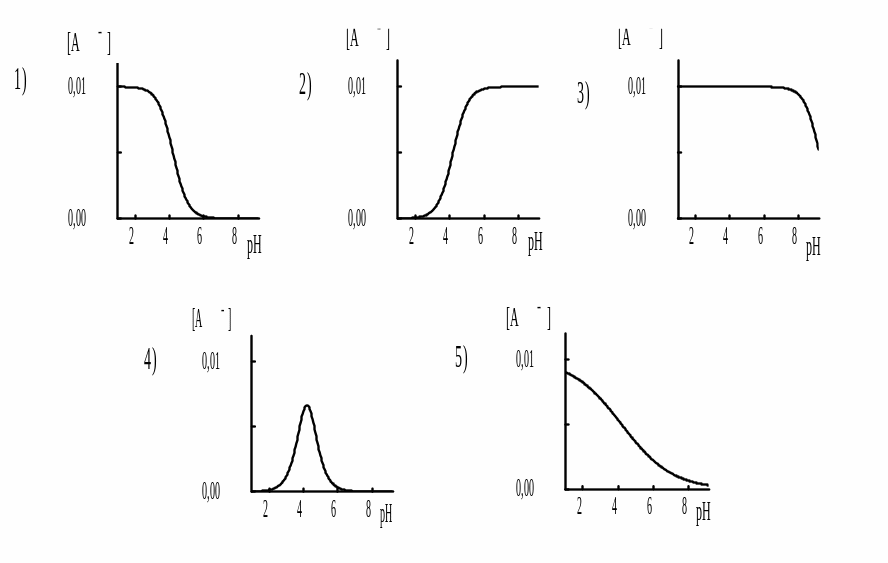
4. Значения pKa1, pKa2 и pKa3 для фосфорной кислоты равны, соответственно, 2,12;7,21 и 12,3. К раствору H3PO4 прибавили NaOH до pH 7,0. Равновесная концентрация какой из частиц в полученном растворе будет наибольшей?
1) H3PO4; 2) H2PO4-; 3) HPO42-;
4) PO43-; 5) HPO42- и PO43-.
5. В каких случаях при смешивании указанных ниже растворов будут образовываться кислотно-основные буферные системы?
50 мл 0,01 М HCl + 50 мл 0,01 М NaOH;
25 мл 0,1 М HCl + 50 мл 0,1 М NH3;
50 мл 110-4 М HCl + 25 мл 110-4 М NH3;
50 мл 0,1 М NH3 + 50 мл 0,1 М CH3COOH;
75 мл 0,1 М Na2CO3 + 50 мл 0,1 М HCl.
6. Ацетатный буферный раствор имеет рН 3,75. Что из перечисленного верно для данного раствора?
С(СH3COO-) = С(СH3COOH);
С(СH3COO-) = 0,1С(СH3COOH);
С(СH3COOH) = 0,1С(СH3COO-);
С(СH3COOH) = 100С(СH3COO-);
С(СH3COO-) = 100С(СH3COOH).
7. Какая из перечисленных ниже буферных систем обладает самой большой буферной ёмкостью?
0,03 M KH2PO4 / 0,03 M Na2HPO4;
0,01 M KH2PO4 / 0,05 M Na2HPO4;
0,05 M KH2PO4 / 0,02 M Na2HPO4;
0,05 M KH2PO4 / 0,05 M Na2HPO4;
0,05 M KH2PO4 / 0,01 M Na2HPO4.
8. Необходимо, чтобы в процессе проведения анализа рН раствора оставался равным 3. Какой буферный раствор лучше всего подходит для поддерживания такого значения рН?
KH2PO4 + NaHPO4; 2) CH3COOH + CH3COONa;
3) лимонная к-та + дигидроцитрат натрия;
4) дигидроцитрат натрия + гидроцитрат натрия; 5) NH4Cl + NH3.
9. Найдите ряд, в котором присутствуют только представители 6-й аналитической группы по кислотно-основной классификации
1) Cu2+, Cr3+, Ca2+, Co2+, Cd2+; 2) Ni2+, Cu2+, Mn2+, Mg2+, Zn2+;
3) Cd2+, Co2+, Hg2+, Ni2+, Cu2+; 4) Co2+, Fe2+, Ba2+, Hg2+, Li+;
5) Cd2+, Co2+, Ni2+, Cu2+, Hg22+.
10. Формула, приведенная ниже, соответствует

1) дифенилкарбазиду; 2) рубеановодородной кислоте;
3) дитизону; 4) ализарину; 5) диметилглиоксиму.
Барбиталовый буферный раствор содержит в своём составе диэтилбарбитуровую кислоту (pKa = 7,98) и её натриевую соль (барбитал-натрий).
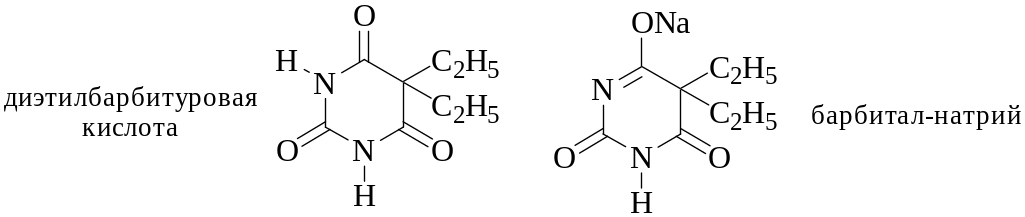
Для приготовления буферного раствора к 100 мл раствора с концентрацией барбитала-натрия 8,25 г/л (M = 206,2 г/моль) прибавляли некоторый объём 0,20 М HCl. Какой объём раствора HCl следует взять, чтобы получить буферный раствор с рН 7,50? Какую буферную ёмкость имеет полученный раствор и какова его ионная сила?
Рассчитаем соотношение количества вещества барбитуровой кислоты и барбитала натрия в растворе, рН которого равен 7,50. Согласно уравнению Гендерсона-Хассельбаха:
![]()
![]() или
или
![]()
Количество вещества барбитала-натрия, содержащееся в исходном растворе, взятом для приготовления буферного раствора, равно
![]() моль
моль
Количество вещества образовавшейся кислоты равно количеству вещества добавленного HCl. Таким образом:
![]()
Отсюда:
![]() моль и
моль и
![]() =
=
![]() л
или 15 мл.
л
или 15 мл.
Будем считать, что объём буферного раствора равен сумме объёмов раствора барбитала-натрия и раствора HCl, т.е. 115 мл.
Концентрации компонентов буферного раствора равны
![]() моль/л
моль/л
![]() моль/л
моль/л
Буферная ёмкость равна
![]() моль/л
моль/л
Величина ионной силы данного буферного раствора определяется присутствием сильных электролитов - барбитала-натрия и NaCl. Поскольку данные электролиты являются бинарными и образованы однозарядными ионами, то ионная сила раствора равна сумме их молярных концентраций
![]()
Рассчитайте рН раствора щавелевой кислоты с массовой концентрацией растворённого вещества 0,90 г/л. Ответ: 2,06.
Рассчитайте рН 1,010-1 М NH4CN. Ответ: 9,27.
Определите равновесную концентрацию частиц S2- в растворе с общей концентрацией H2S 1,010-2 моль/л, если рН данного раствора равен 11,0. Ответ: 2,410-4 моль/л.
Сколько граммов ацетата натрия необходимо растворить в 0,50 л 2,010-2 М CH3COOH, чтобы рН раствора стал равен 5,50? Какой объём 1,0 М NaOH понадобится для этой цели? Ответ: 4,6 г, 8,5 мл.
К 40,0 мл 5,010-2 М KH2PO4 прибавили 60,0 мл 5,010-2 М Na2HPO4. Рассчитайте рН и буферную ёмкость полученного раствора. Ответ: 7,38; 2,810-2.
Смешали по 50,0 мл раствора с массовой концентрацией CH3COOH 10,0 г/л и раствора с массовой концентрацией HCOOH 5,00 г/л. Рассчитайте рН полученной смеси.
Смешали равные объёмы 1,010-3 М HCl и 5,010-1 М HCOOH. Рассчитайте рН полученной смеси.
Рассчитайте рН водного раствора пиридоксина гидрохлорида (М= 205,6 г/моль) с концентрацией 10,0 г/л, если pKa N-H кислотного центра равен 5,0, а pKa фенольного гидроксила - 9,0.

Рассчитайте рН лекарственного препарата, имеющего следующий состав: гексаметилентетрамина и натрия бензоата по 2,0 г, воды дистиллированной до 100,0 мл. Значение KBH+ для гексаметилентетрамина /(СH2)6N4/ равно 1,310-5.
Рассчитайте рН раствора гидрокарбоната натрия с массовой концентрацией растворённого вещества 50,0 г/л.
Значения рKa этилендиаминтетрауксусной кислоты (ЭДТА) – H6Y2+ - равны: pKa3 = 2,0; pKa4 = 2,67; pKa5 = 6,16; pKa6 = 10,26. Рассчитайте
 при рН 10,0. Какие из констант можно не
учитывать для такого значения рН?
при рН 10,0. Какие из констант можно не
учитывать для такого значения рН?В каком соотношении объёмов необходимо смешать 2,0010-1 М CH3COOH и 2,0010-1 М CH3COONa, чтобы получить раствор, имеющий буферную ёмкость 0,115 моль/л? Чему равна величина рН этого раствора?
Какие минимальные концентрации аммиака и хлорида аммония должны быть в буферном растворе, чтобы его рН был равен 9,00, а при добавлении к 1,00 л раствора 1,010-3 моль сильной кислоты значение рН уменьшалось бы не более, чем на 0,02?
Фосфатный буферный раствор готовили по следующей прописи: к 50 мл раствора с концентрацией KH2PO4 13,6 г/л прибавляли некоторое количество 1,010-1 М NaOH и затем разбавляли водой до 100 мл. Какой объём 1,010-1 М NaOH следует взять для получения буферного раствора, имеющего рН 7,2. Какую буферную ёмкость имеет такой буферный раствор?
Аммиачный буферный раствор готовили по следующей методике: в некотором объёме 5,010-1 М NH3 растворяли определённую навеску NH4Cl и полученный раствор доводили водой до 1,00 л. Какой должна быть масса навески хлорида аммония и в каком объёме раствора аммиака следует её растворить, чтобы полученный буферный раствор имел рН 9,50 и буферную ёмкость 0,10?
РЕАКЦИИ ОБНАРУЖЕНИЯ КАТИОНОВ VI АНАЛИТИЧЕСКОЙ ГРУППЫ
Реакции ионов Сu2+
