
- •Раздел 1
- •Занятие 1
- •Цель занятия
- •Карбонаты щелочных металлов
- •Отделение ионов аммония
- •Действие щелочей и аммиака
- •Оксалат аммония
- •Родизонат натрия (или калия)
- •Занятие 2
- •Цель занятия
- •1. На чем основано разделение катионов согласно кислотно-основной классификации?
- •2. В какой строке перечислены все групповые реагенты, используемые в кислотно-основной схеме анализа?
- •Цель занятия
- •Цель занятия
- •Салициловая кислота (сульфосалициловая кислота)
- •Цель занятия
- •1. В растворе присутствуют hCl (0,1 моль/л) и h3bo3 (0,01 моль/л). Что можно сказать о рН данного раствора?
- •Действие щелочей
- •Действие щелочей
- •Действие щелочей
- •Гексацианоферрат (II) калия
- •Цель занятия
- •1. Что из перечисленного ниже верно? Гидроксиды алюминия, цинка, хрома (III) растворимы в:
- •5. Найдите ряд, в котором содержится больше всего катионов, выпадающих в осадок в виде гидроксидов и оксосолей при обработке анализируемого раствора избытком 6 м NaOh и 6 м nh3.
- •Цель занятия
- •5. Обнаружение анионов scn- и I-
- •Цель занятия
- •Занятие 9
- •Цель занятия
- •1. В насыщенном водном растворе какого из перечисленных ниже веществ равновесная концентрация ионов металла будет наименьшей (в скобках приведены значения ks)?
- •Занятие 10
- •Цель занятия
- •1. Какие из перечисленных ниже процессов невозможны (дайте ответ, не проводя расчётов)?
- •2. Какая из частиц, выделенных полужирным шрифтом, является самым сильным окислителем?
- •3. Какая из частиц, выделенных полужирным шрифтом, является самым сильным восстановителем?
- •7. Какой из малорастворимых электролитов, формулы которых приведены ниже, обладает самым малым произведением растворимости?
- •9. Вывод об отсутствии какого ряда анионов можно сделать, если известно, что при добавлении к анализируемому раствору разбавленного раствора сильной кислоты не происходит выделения пузырьков газа?
- •10. При добавлении к анализируемому раствору ki в кислой среде не происходит появления бурой окраски вследствие выделения иода. Все анионы какого ряда можно не искать при дальнейшем анализе?
- •Занятие 11
- •Цель занятия
- •Предварительные испытания
- •Занятие 12
- •Цель занятия
- •4. Какой из приведенных ниже графиков отражает зависимость константы распределения предельных монокарбоновых кислот между хлороформом и водой в зависимости от числа атомов углерода в молекуле кислоты?
- •2. Экстракция диметилглиоксиматов никеля и кобальта
- •3. Экстракция соединения комплексного аниона [SbCl6]- с малахитовым зеленым
- •4. Экстракционное разделение I- и Br-
- •5. Экстракция ионного ассоциата берберина с трихлорацетат-анионом
- •6. Экстракция ионного ассоциата димедрола с метиловым оранжевым
- •Раздел 2
1. В насыщенном водном растворе какого из перечисленных ниже веществ равновесная концентрация ионов металла будет наименьшей (в скобках приведены значения ks)?
1) CuS (6,310-36); 2) HgS (1,610-52); 3) Ag2S (6,310-20);
4) MnS (2,510-10); 5) PbS (2,510-27).
2. Произведение растворимости малорастворимого сильного электролита AB равно 110-8. К 100 мл раствора, в котором концентрация иона Ax+ составляет 110-3 моль/л, прибавляют 100 мл раствора, в котором концентрация иона By- составляет C моль/л. При каких значениях С произойдёт выпадение осадка?
1) 110-5 моль/л; 2) 110-2 моль/л; 3) 110-8 моль/л; 4) 510-3 моль/л;
5) 510-6 моль/л.
3. Произведение растворимости малорастворимого сильного электролита A2B равно 410-12. Ни катион, ни анион, входящий в состав осадка, не вступают в побочные реакции (комплекообразование, протонирование и т.д.). Чему равна растворимость A2B?
1) 110-4 моль/л; 2) 110-6 моль/л; 3) 110-12 моль/л
4) 210-12 моль/л; 5) 210-6 моль/л.
4. Значение KS для малорастворимого комплекса AB равно 1,010-8, а величина константы образования - 2,0103. Молекулярная растворимость АВ равна:
1) 2,010-5 моль/л; 2) 2,010-6 моль/л; 3) 2,010-8 моль/л;
4) 2,010-3 моль/л; 5) 2,010-11 моль/л.
5. Значение KS для слабой кислоты AB равно 1,010-6, а величина константы кислотности - 1,010-4. Молекулярная растворимость АВ равна:
1) 1,010-6 моль/л; 2) 1,010-4 моль/л; 3) 1,010-2 моль/л
4) 1,010-10 моль/л; 5) 1,010-1 моль/л.
6. Что из перечисленного приведёт к наиболее сильному увеличению растворимости оксалата бария?
1) повышение ионной силы от 0 до 0,5;
нагревание раствора от 20 до 40С;
добавление к 100 мл раствора 0,1 моль NaCl
добавление к 100 мл раствора 0,1 М NaOH
добавление к 100 мл раствора 0,1 моль HCl
7. Для каких из приведенных ниже соединений уменьшение рН от 7 до 3 приводит к заметному увеличению растворимости?
1) BaCO3; 2) AgI; 3) MnS; 4) SrSO4; 5) СuSCN.
8. Найдите последовательности анионов, все представители которых выпадают в осадок при действии AgNO3 в присутствии HNO3
1) CO32-, PO43-, SO42-; 2) Cl-, Br-, I-;
3) CNS-, BrO3-, I-; 4) CH3COO-, NO2-, NO3-;
5) SO32-, S2O32-, SO42-.
9. Найдите ряд, все представители которого взаимодействуют с KI в кислой среде с образованием I2.
1) BrO3-, NO2-, IO3-; 2) Cl-, Br-, I-;
3) CNS-, CH3COO-, NO3-;4) CH3COO-, NO2-, NO3-;
5) SO32-, S2O32-, SO42-.
10. Формула, приведенная ниже, соответствует

1) дифениламину; 2) куркумину;
3) -нафтолу; 4) антипирину;
5) ни одному из перечисленных соединений.
Рассчитайте (без учёта влияния ионной силы) растворимость оксалата цинка 1) при равновесной концентрации NH3 в растворе равной 0,10 моль/л; 2) при рН 2,0; 3) в 1,010-3 М HNO3.
Для расчётов нам понадобятся следующие справочные данные: произведение растворимости ZnC2O4 - KS = 2,7510-8, константы образования аммиачных комплексов Zn2+: 1 = 1,5102, 2 = 2,7104, 3 = 8,5106, 4 = 1,2109, 5 = 2,9109, 6 = 5,61012, константы кислотности щавелевой кислоты: Ka1 = 5,610-2, Ka2 = 5,410-5.
Ионы, образующиеся при растворении осадка оксалата цинка, могут вступать в следующие реакции:

Протекание данных реакций приводит к уменьшению равновесной концентрации ионов Zn2+ и С2О42- и, следовательно, к повышению растворимости оксалата цинка.
Задание 1. Рассчитаем молярную долю ионов Zn2+, не связанных в аммиачные комплексы при [NH3] = 0,10 моль/л.
![]() =
=
![]() =
1,710-7
=
1,710-7
Рассчитаем значение условного произведения растворимости оксалата цинка при [NH3] = 0,10 моль/л.
![]()
Следовательно, растворимость оксалата цинка составит
![]() моль/л
моль/л
Задание 2.
Рассчитаем
![]() при рН 2,0.
при рН 2,0.
![]()
=
![]()
Рассчитаем значение условного произведения растворимости оксалата цинка.
![]()
Следовательно, растворимость оксалата цинка равна
![]() моль/л
моль/л
Задание 3. Расчёт растворимости отличается от задания 2, так как рН раствора в процессе растворения не остаётся постоянным, а увеличивается (некоторое количество H3O+ затрачивается на реакцию с оксалат-ионами).
Растворение оксалата цинка в 1,010-3 М HNO3 можно описать следующим равновесием:
ZnC2O4 + H3O+ Zn2+ + HC2O4- + H2O
Данное равновесие можно описать с помощью константы равновесия
 =
=

 =
=
![]()
Так как
![]() и
и
![]() ,
то
,
то
![]()
![]()
S = 2,810-4 моль/л
Если бы рН в процессе растворения остался равным трём, то растворимость оксалата цинка составляла бы 7,410-4 моль/л.
Выпадет ли осадок фторида кальция, если к 1 мл раствора с массовой долей Ca(NO3)2 0,1% прибавить 2 капли (0,1 мл) раствора с массовой долей NaF 1%? Ответ: да (210-6 > 4,010-11).
В каком объёме воды может раствориться 1,0 г иодата бария? Ответ: 2,8 л.
Во сколько раз можно повысить растворимость хромата серебра, если в 1,00 л его насыщенного раствора растворить 10,0 г KNO3. Ответ: в 1,7 раза.
Рассчитайте молярную концентрацию BaC2O4 в его насыщенном растворе, рН которого равен 3,0. Ответ: 1,510-3 моль/л
Сколько граммов AgI можно растворить в 100 мл 1,0 М NH3? Ответ: 8,810-4 г.
Ионная растворимость BaSO4 в 1,010-1 М NH4NO3 при 25 С составляет 6,80 мг/л. Рассчитайте величину
 сульфата
бария.
сульфата
бария.Какая масса иодата бария (мг) может раствориться в 500 мл 1,010-2 М NaIO3. Влияние ионной силы на растворимость не учитывать.
Рассчитайте минимальную массу BaSO4, которая будет оставаться в 1,0 л насыщенного раствора этого вещества при добавлении к нему избытка сульфата натрия. Влияние ионной силы на константы равновесия не учитывать. Константа образования комплекса BaSO4 равна 2,3102.
Рассчитайте массу бензойной кислоты (KS = 1,410-6), которая содержится в 5,010-1 л: 1) её насыщенного водного раствора; 2) её насыщенного раствора, рН которого равен 2,0. Влиянием ионной силы на растворимость пренебречь.
Рассчитайте растворимость AgI в 1,010-2 М KI. Логарифмы констант образования иодидных комплексов серебра равны: lg1 = 6,58, lg2 = 11,74, lg3 = 13,68, lg4 = 13,10.
Образуется ли осадок Mg(OH)2, если к 25 мл 1,010-3 М Mg(NO3)2 прибавить такой же объём аммиачного буферного раствора, полученного при смешивании равных объёмов 0,20 М NH3 и 0,10 М NH4Cl?
Рассчитайте растворимость гидроксида цинка при рН 12,0. Логарифмы констант образования гидроксидных комплексов цинка равны: lg1 = 6,04, lg2 = 11,1, lg3 = 13,6, lg4 = 14,8.
Образуется ли осадок AgSCN, если к 100 мл 1,010-4 М AgNO3 прибавить 100 мл 1,010-1 М KSCN? Логарифмы констант образования тиоцианатных комплексов серебра равны lg1 = 4,75, lg2 = 8,23, lg3 = 9,45, lg4 = 9,67.
При каком минимальном значении рН образуется осадок CaCO3 из раствора, в котором общие концентрации ионов кальция и угольной кислоты равны 1,010-3 моль/л?
Рассчитайте молярную концентрацию NH3 в растворе, необходимую для того, чтобы растворимость бромида серебра в нём составляла 1,010-3 моль/л. Логарифмы констант образования аммиачных комплексов серебра равны lg1 = 3,32, lg2 = 7,23.
РЕАКЦИИ ОБНАРУЖЕНИЯ АНИОНОВ II И III АНАЛИТИЧЕСКИХ ГРУПП
Анионы II аналитической группы
Реакции ионов Сl-
1. Нитрат серебра
Ag+ + Cl- AgCl
белый творожистый
Осадок не растворяется в разбавленной HNO3 и растворяется в концентрированной HCl, растворах NH3, Na2S2O3 и др. с образованием комплексных соединений. На свету осадок чернеет.
2. Нитрат свинца
Pb2+ + 2Cl- PbCl2
белый
Свойства осадка - см. с. 14.
3. Нитрат ртути (I)
Hg22+ + 2Cl- Hg2Cl2
белый
Свойства осадка - см. с. 14.
Реакции Br-
1. Нитрат серебра
Ag+ + Br- AgBr
бледно-жёлтый
Осадок растворяется в растворе Na2S2O3, в растворе NH3 растворимость меньше, чем у AgCl.
2. Нитрат свинца
Pb2+ + 2Br- PbBr2
бледно-жёлтый
Свойства осадка - см. с. 14.
3. Действие окислителей
перманганат калия
2MnO4- + 10Br- + 16H+ 5Br2 + 2Mn2+ + 8H2O
хлорамин

Образовавшийся Br2 экстрагируют неполярным растворителем. Слой неполярного растворителя окрашивается в оранжевый цвет.
В пробирку вносят несколько капель раствора, содержащего Br-, прибавляют по 3-4 капли 1 М H2SO4 и раствора хлорамина (или KMnO4). Наблюдают изменение окраски раствора. Затем добавляют 0,5 мл хлороформа и взбалтывают содержимое пробирки. Отмечают окраску хлороформного слоя (нижнего).
Реакции ионов I-
1. Нитрат серебра
Ag+ + I- AgI
жёлтый
Осадок растворяется в растворе Na2S2O3 и практически не растворяется в растворе NH3.
2. Нитрат свинца
Pb2+ + 2I- PbI2
жёлтый
Свойства осадка - см. с. 14.
3. Действие окислителей
хлорамин
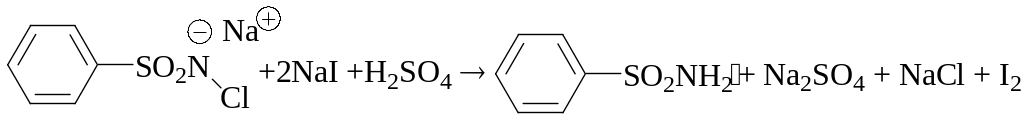
Выделившийся иод экстрагируют неполярным растворителем. Слой неполярного растворителя окрашивается в фиолетовый цвет. При добавлении избытка хлорамина иод окисляется до HIO3 и фиолетовая окраска исчезает.

В пробирку вносят 1 каплю раствора NaI и разбавляют водой до 1мл. Затем подкисляют раствором H2SO4 до кислой реакции, добавляют 1мл хлороформа и по каплям раствор хлорамина, перемешивая содержимое пробирки после добавления каждой порции реагента. Раствор хлорамина добавляют до тех пор, пока окраска фиолетовая окраска хлороформного слоя не исчезнет.
хлорид железа (III)
2Fe3+ + 2I- I2 + 2Fe2+
бурый
нитрит натрия
2NO2- + 2I- + 4H+ I2 + 2NO + 2H2O
бурый
Реакцию проводят в слабокислой среде.
К раствору NaI прибавляют раствор CH3COOH до рН около 6, затем добавляют несколько капель раствора NaNO2. Раствор окрашивается в бурый цвет. При нагревании раствора выделяются фиолетовые пары иода и в конце концов раствор обесцвечивается.
Обнаружение выделившегося иода можно также проводить по окраске хлороформного слоя или с помощью крахмала. При взаимодействии иода с крахмалом образуется соединение синего цвета.
Реакции ионов S2-
1. Нитрат серебра
2Ag+ + S2- Ag2S
чёрный
Осадок растворяется при нагревании в разбавленной HNO3 и не растворяется в растворе NH3.
2. Нитрат кадмия
Cd2+ + S2- CdS
жёлтый
3. Разбавленные кислоты (H2SO4, HCl)
S2- + 2H+ H2S
Обнаружение сероводорода проводят по запаху и по почернению бумажки, смоченной раствором ацетата свинца.
Pb2+ + H2S PbS + 2H+
4. Действие окислителей.
5S2- + 2MnO4- + 16H+ 5S + 2Mn2+ + 8H2O
S2- + I2 S + 2I-
Аналитический эффект реакций - исчезновение исходной окраски раствора реагента и появление мути (образование осадка серы).
5. Нитропруссид натрия Na2[Fe(CN)5NO]
Na2S + Na2[Fe(CN)5NO] Na4[Fe(CN)5NOS]
красно-фиолетовый
Реакция протекает только в щелочной среде.
В пробирку помещают 3-4 капли раствора Na2S и по 2-3 капли растворов Na2[Fe(CN)5NO] и NaOH.
Реакции ионов SСN-
1. Нитрат серебра
Ag+ + SCN- AgSCN
белый
Осадок не растворяется в разбавленной HNO3 и растворяется в присутствии избытка SCN-, а также в растворах Na2S2O3, NH3 и т.д.
2. Нитрат меди
Cu2+ + 2SCN- Cu(SCN)2
чёрный
При добавлении к раствору, содержащему Cu2+, раствора, содержащего SCN-, вначале появляется изумрудно-зелёное окрашивание, а затем - чёрный осадок.
3. Нитрат ртути (II)
Hg2+ + 2SCN- Hg(SCN)2
белый
Осадок растворяется в присутствии избытка SCN- с образованием [Hg(SCN)4]2-.
4. Хлорид железа (III)
Fe3+ + nSCN- [Fe(SCN)n]3-n, где n=1-6
кроваво-красный
Реакции ионов BrO3-
1. Нитрат серебра
Ag+ + BrO3- AgBrO3
бледно-жёлтый
Осадок растворяется в разбавленной HNO3 и растворе NH3.
2. Нитрат бария
Ba2+ + 2BrO3- Ba(BrO3)2
белый кристаллический
Осадок растворим в разбавленных минеральных кислотах.
3. Бромиды в кислой среде
BrO3- + 5Br- + 6H+ Br2 + 3H2O
О выделении брома судят по появлению жёлтой окраски раствора, запаху и изменении окраски хлороформного слоя на оранжевую.
Анионы III аналитической группы
Реакции ионов СН3СОО-
1. Действие кислот
2 CH3COONa + H2SO4 2 CH3COOH + Na2SO4
запах
В пробирку вносят по 5-6 капель раствора ацетата натрия и 1 М H2SO4. Нагревают на водяной бане.
2. Реакция образования этилацетата
2 CH3COONa + H2SO4 + 2C2H5OH 2 CH3COOС2H5 + Na2SO4
запах
В пробирку вносят немного твёрдого CH3COONa (или несколько капель его раствора), добавляют по 3-4 капли концентрированной H2SO4 и C2H5OH. Нагревают на водяной бане.
3. Хлорид железа (III)
3Fe3+ + 9CH3COO- + 2H2O [Fe3(CH3COO)6(OH)2]CH3COO + 2CH3COOH
тёмно-красный
Состав осадка предположительный.
В пробирку вносят по 5-6 капель раствора FeCl3 и ацетата натрия. Добавляют 1-2 мл воды, нагревают до кипения и кипятят некоторое время.
Реакции ионов NO2-
1. Действие кислот (H2SO4, HCl)
2NO2- + 2H+ 2HNO2 NO2 + NO + H2O
бурый
2. Дифениламин

В такую же реакцию вступают ионы NO3- и другие окислители.
В углубление фарфоровой пластинки помещают 2-3 капли раствора дифениламина в концентрированной серной кислоте, добавляют 1 каплю раствора NaNO2 и осторожно перемешивают стеклянной палочкой.
3. Реакция получения азокрасителя

В пробирку помещают 3-4 капли раствора NaNO2, прибавляют 2-3 капли 2 М HCl и 3-4 капли раствора сульфаниловой кислоты. Затем добавляют 4-5 капель 2 М NaOH и 3-4 капли раствора -нафтола.
4. Антипирин

К 5-6 каплям раствора NaNO2 прибавляют такой же объём 5% раствора антипирина и 1 каплю концентрированной H2SO4.
4. Иодид калия
2I- + 2NO2- + 4H+ I2 + 2 NO + 2 H2O
бурый
При взаимодействии иода с крахмалом образуется соединение синего цвета.
Реакции ионов NO3-
1. Восстановление нитратов медью
2NO3- + 8H+ + 3Cu 3Cu2+ + 2NO + 4H2O
2NO + O2 2NO2
бурый газ
2. Дифениламин
Уравнение реакции и методику её выполнения см. с. 95.
3. Антипирин

К раствору, содержащему NO3-, прибавляют раствор антипирина, 1 каплю концентрированной H2SO4 и нагревают.
