
- •Раздел 1
- •Занятие 1
- •Цель занятия
- •Карбонаты щелочных металлов
- •Отделение ионов аммония
- •Действие щелочей и аммиака
- •Оксалат аммония
- •Родизонат натрия (или калия)
- •Занятие 2
- •Цель занятия
- •1. На чем основано разделение катионов согласно кислотно-основной классификации?
- •2. В какой строке перечислены все групповые реагенты, используемые в кислотно-основной схеме анализа?
- •Цель занятия
- •Цель занятия
- •Салициловая кислота (сульфосалициловая кислота)
- •Цель занятия
- •1. В растворе присутствуют hCl (0,1 моль/л) и h3bo3 (0,01 моль/л). Что можно сказать о рН данного раствора?
- •Действие щелочей
- •Действие щелочей
- •Действие щелочей
- •Гексацианоферрат (II) калия
- •Цель занятия
- •1. Что из перечисленного ниже верно? Гидроксиды алюминия, цинка, хрома (III) растворимы в:
- •5. Найдите ряд, в котором содержится больше всего катионов, выпадающих в осадок в виде гидроксидов и оксосолей при обработке анализируемого раствора избытком 6 м NaOh и 6 м nh3.
- •Цель занятия
- •5. Обнаружение анионов scn- и I-
- •Цель занятия
- •Занятие 9
- •Цель занятия
- •1. В насыщенном водном растворе какого из перечисленных ниже веществ равновесная концентрация ионов металла будет наименьшей (в скобках приведены значения ks)?
- •Занятие 10
- •Цель занятия
- •1. Какие из перечисленных ниже процессов невозможны (дайте ответ, не проводя расчётов)?
- •2. Какая из частиц, выделенных полужирным шрифтом, является самым сильным окислителем?
- •3. Какая из частиц, выделенных полужирным шрифтом, является самым сильным восстановителем?
- •7. Какой из малорастворимых электролитов, формулы которых приведены ниже, обладает самым малым произведением растворимости?
- •9. Вывод об отсутствии какого ряда анионов можно сделать, если известно, что при добавлении к анализируемому раствору разбавленного раствора сильной кислоты не происходит выделения пузырьков газа?
- •10. При добавлении к анализируемому раствору ki в кислой среде не происходит появления бурой окраски вследствие выделения иода. Все анионы какого ряда можно не искать при дальнейшем анализе?
- •Занятие 11
- •Цель занятия
- •Предварительные испытания
- •Занятие 12
- •Цель занятия
- •4. Какой из приведенных ниже графиков отражает зависимость константы распределения предельных монокарбоновых кислот между хлороформом и водой в зависимости от числа атомов углерода в молекуле кислоты?
- •2. Экстракция диметилглиоксиматов никеля и кобальта
- •3. Экстракция соединения комплексного аниона [SbCl6]- с малахитовым зеленым
- •4. Экстракционное разделение I- и Br-
- •5. Экстракция ионного ассоциата берберина с трихлорацетат-анионом
- •6. Экстракция ионного ассоциата димедрола с метиловым оранжевым
- •Раздел 2
Цель занятия
Знать:
основные положения протолитической теории кислот и оснований;
константы, характеризующие силу кислот и оснований;
влияние растворителя на кислотно-основные свойства растворённого вещества;
протолитические равновесия в водных растворах сильных и слабых кислот и оснований.
Уметь:
вычислять рН водных растворов сильных и слабых кислот и оснований;
выполнять реакции обнаружения катионов V аналитической группы.
Важнейшие теории кислот и оснований.
Количественное описание силы кислот и оснований
Влияние кислотно-основных свойств растворителя на кислотно-основные свойства растворённого вещества. Протонные и апротонные растворители. Классификация растворителей по кислотно-основным свойствам.
Автопротолиз растворителя. Константа автопротолиза. Водородный показатель. Влияние полярности растворителя на кислотно-основные свойства растворённого вещества.
Нивелирующее и дифференцирующее действие растворителя. Сильные и слабые кислоты и основания.
Расчёт рН водных растворов сильных кислот и оснований.
Расчёт рН водных растворов слабых кислот и слабых оснований.


Можно ли привести однозначные определения для понятий «кислота» и «основание»? Какие теории кислот и оснований Вам известны?
Водный раствор NH4Cl (концентрация растворённого вещества 0,1 моль/л) имеет слабокислую среду, а раствор с такой же концентрацией Na2CO3 - щелочную. Как можно объяснить данные факты с точки зрения теории Аррениуса и протолитической теории?
Почему для характеристики силы основания удобнее использовать не константу основности, а константу кислотности сопряжённой с данным основанием кислоты? Напишите выражение для термодинамической константы кислотности кислоты, сопряжённой с ионом метиламина и концентрационной константы основности основания, сопряжённого с молекулой фенола.
Напишите уравнение автопротолиза для метанола и выражения для термодинамической и концентрационной констант равновесия данного процесса. Укажите ионы лиония и лиата. Рассчитайте величину рН, соответствующую нейтральной среде. К каким растворителям (в зависимости от наличия протонизированных атомов водорода, кислотно-основных свойств, полярности) относится метанол?
Почему уксусная кислота имеет значительно меньшую константу автопротолиза, чем муравьиная? Какой из данных растворителей имеет больший полезный интервал кислотности?
Дайте определение понятию «сильная кислота» («сильное основание») с точки зрения протолитической теории. Почему HCl в воде является сильной кислотой, а в уксусной кислоте – слабой (pKa = 5,3).
Приведите примеры трёх кислот и трёх оснований, на которые вода оказывает нивелирующее действие.
Что такое водородный показатель? Почему значения рН, определённые экспериментально (потенциометрически), нельзя в точности отнести ни к концентрации, ни к активности ионов H3O+?
Почему шкалу рН не используют для концентрированных растворов кислот (или щелочей)?
Для расчёта рН уксусной кислоты можно использовать формулу pH = 1/2(pKa – lgC), в то время как расчёт рН раствора трихлоруксусной кислоты по этой формуле проводить нельзя. Объясните, какое допущение, использованное при выводе данной формулы, правильно для уксусной кислоты, но неправильно для трихлоруксусной?
1. Сопряжённое с какой из перечисленных ниже кислот основание обладает в водном растворе самыми слабыми основными свойствами?
1) HClO; 2) HClO4; 3) HF; 4) HNO2; 5) HCN.
2. Какие из перечисленных растворителей относятся к протофильным?
1) 1,2-дихлорэтан; 2) уксусная кислота; 3) пиридин
4) диметилформамид; 5) н-гексан.
3. Какой из перечисленных растворителей имеет самый большой полезный интервал кислотности?
1) C2H5OH; 2) H2O; 3) HCOOH; 4) CH3OH; 5) H2SO4.
4. Показатель константы кислотности уксусной кислоты в этаноле равен 10,4. Чему равен показатель константы основности ацетат-иона в данном растворителе?
1) 3,6; 2) 7,0; 3) 8,7; 4) 10,4; 5) 14,7.
5. Величина рH = -lg[C2H5OH2+], соответствующая нейтральной среде в этаноле, равна:
7; 2) 19,1; 3) 5,55; 4) 9,55; 5) 14.
6. Как будет изменяться рН раствора в процессе разбавления 0,1 М HCl водой?

7. Сколько NaOH необходимо взять для того, чтобы получить 1 л раствора гидроксида натрия, имеющего рН 12?
1) 40 мг; 2) 400 мг; 3) 4000 мкг; 4) 4 г; 5) 40 г.
8. Имеются 0,1 М водные растворы перечисленных ниже веществ. У какого раствора рН будет наибольшим?
1) NaF; 2) NaNO2; 3) NaClO; 4) NaCl; 5) Na3PO4.
9. В каком ряду содержится больше всего представителей 5 аналитической группы катионов?
1) Fe2+, Co2+, Na+, Ba2+, Hg2+; 2) Al3+, Mg2+, Hg22+, Cr3+, K+;
3) Fe3+, Cd2+, Ni2+, Sr2+, Ag+; 4) Mn2+, Bi3+, Li+, Fe3+, Sb3+;
5) Na+, Zn2+, Cu2+, Al3+, NH4+.
10. Какая из перечисленных ниже формул соответствует бриллиантовому зелёному?

Рассчитайте рН а) 0,10 М NaOH; б) раствора с массовой долей муравьиной кислоты 0,46%. Какое значение рН будет иметь раствор, полученный при смешивании равных объёмов данных растворов?
Гидроксид натрия является сильным основанием:
pH = pKW + lgC(NaOH) = 14,0 + lg 0,10 = 13,0
Для того чтобы рассчитать значение рН раствора муравьиной кислоты, вначале определим молярную концентрацию данного вещества в растворе. Поскольку раствор достаточно разбавленный, то его плотность можно считать равной примерно 1,0 г/мл. Масса растворённого вещества, содержащегося в 100 мл раствора, равна 0,46 г.
![]() =
0,10 моль/л
=
0,10 моль/л
Муравьиная кислота является слабой кислотой (pKa = 3,75). В водном растворе этого вещества имеет место равновесие
HCOOH + H2O HCOO- + H3O+
Данное равновесие описывается константой равновесия, представляющей собой константу кислотности муравьиной кислоты
![]()
Концентрация протонов, образующихся при взаимодействии муравьиной кислоты с водой, значительно больше, чем образующихся в результате автопротолиза воды, поэтому
[HCOO-] = [H3O+]
Степень протолиза муравьиной кислоты в 0,10 М растворе не превышает 5%, поэтому можно считать, что [HCOOH] CHCOOH.
Оценить величину степени протолиза слабой кислоты можно следующим образом
![]()
Таким образом
![]()
![]()
рH
=
![]() =
=
![]() =
2,38
=
2,38
Молярные концентрации растворённого вещества в исходных растворах NaOH и HCOOH равны, поэтому при смешивании равных объёмов данных растворов вещества прореагируют полностью с образованием HCOONa. Его молярная концентрация в растворе равна
![]() =
5,010-2
моль/л
=
5,010-2
моль/л
Величина рН раствора формиата натрия определяется слабым основанием (HCOO-)
HCOO- + H2O HCOOH + OH-
Для того чтобы рассчитать рН раствора данного вещества, воспользуемся константой кислотности муравьиной кислоты
Степень протолиза формиат-иона не превышает 5%, поэтому можно считать, что [HCOO-] CHCOO-.
Оценить величину степени протолиза слабого основания можно следующим образом
![]()
Так как [HCOOH]
= [OH-]
=
![]() ,
то
,
то
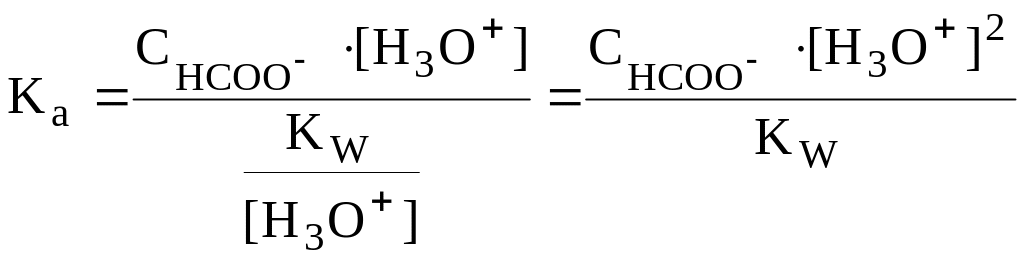

![]() = 8,22
= 8,22
Пробу 1,010-2 М KOH объёмом 10,0 мл разбавили водой до 1,00 л. Рассчитайте рН полученного раствора. Каким станет значение рН, если 1,00 мл полученного раствора также разбавить водой до 1,00 л? Ответ: 10,0; 7,21 (теоретически).
В 1,00 л воды растворили 1,12 л (н.у.) хлороводорода. Рассчитайте рН полученного раствора с учётом и без учёта его ионной силы. Ответ: 1,37; 1,30.
Водный раствор бензойной кислоты имеет рН 3,10. Чему равна массовая концентрация (г/л) бензойной кислоты в данном растворе? Ответ: 1,3 г/л.
Рассчитайте рН раствора, полученного при смешивании равных объёмов раствора с концентрацией фенола 4,70 г/л и 5,010-2 М KOH. Ответ: 11,1.
Сколько граммов ацетата натрия содержится в 100 мл раствора данного вещества, если рН этого раствора равен 8,50? Ответ: 1,510-1 г.
Какой объём раствора HCl с массовой концентрацией растворённого вещества 83,0 г/л следует взять, чтобы при разбавлении его водой до 500,0 мл был получен раствор, рН которого равен 2,50?
В 0,50 л воды растворили 0,14 г KOH. Чему равен рН полученного раствора? Сколько граммов KOH необходимо добавить к этому раствору, чтобы его рН стал равен 12,5.
Какое значение Ka должна иметь кислота, чтобы рН её водного раствора с концентрацией 0,10 моль/л был равен 1,30?
Лекарственное вещество димедрол (М 292 г/моль) имеет pKa = 9,0. Рассчитайте рН водного раствора с концентрацией димедрола 10,0 г/л.

В 100 мл воды растворили 4,10 г трихлоруксусной кислоты. Раствор разбавили водой до 1,00 л. Какое значение рН будет иметь полученный при этом раствор?
Водный раствор гидросульфата натрия имеет рН 2,00. Рассчитайте массу NaHSO4, содержащегося в 100,0 мл такого раствора.
Водный раствор вещества B, являющегося однокислотным основанием, имеет рН 11,5. Концентрация растворённого вещества в данном растворе равна 1,5010-1 моль/л. Рассчитайте величину рКa кислоты, сопряжённой с веществом В.
Рассчитайте рН раствора натриевой соли 5,5-диэтилбарбитуровой кислоты (pKa = 7,98) /лекарственное средство барбитал-натрий/c концентрацией растворённого вещества 50,0 г/л. Молярная масса барбитал-натрия равна 206,2 г/моль.

9. Сколько граммов бензоата натрия, содержится в 100 мл раствора данного вещества, рН которого равен 9,00.
10. Раствор с неизвестной концентрацией NH3 объёмом 0,100 л разбавили водой до 1,00 л. При измерении рН полученного раствора оказалось, что он равен 11,5. Чему была равна молярная концентрация NH3 в исходном растворе?
РЕАКЦИИ ОБНАРУЖЕНИЯ КАТИОНОВ V АНАЛИТИЧЕСКОЙ ГРУППЫ
Реакции ионов Mg2+
1. Растворимые карбонаты
2Mg2+ + 2CO32- + Н2О (MgOH)2CO3 + CO2
белый аморфный
Образующийся осадок растворим в кислотах.
2. Гидрофосфат натрия Na2HPO4
Mg2+ + HPO42- + NH3 MgNH4PO4
белый кристаллический
Для того чтобы произошло образование кристаллического осадка фосфата аммония-магния, реакцию необходимо проводить при рН 9 (аммиачный буферный раствор). При взаимодействии ионов Mg2+ и HPO42- в нейтральной среде образуется аморфный осадок MgHPO4, а при рН > 10 - также аморфный Mg3(PO4)2. Реакцию можно выполнить в пробирке или как микрокристаллоскопическую.
1. В пробирку вносят по 2-3 капли раствора соли Mg2+ и Na2HPO4, прибавляют 3-4 капли 2 M HCl. Осадок при этом не должен выпадать. Затем в пробирку добавляют 1 каплю раствора фенолфталеина и по каплям 2 М NH3 до появления слабо розового окрашивания. После добавления каждой капли раствора NH3 содержимое пробирки тщательно перемешивают. Для ускорения образования осадка внутренние стенки пробирки можно потереть стеклянной палочкой.
2. На предметное стекло наносят 1 каплю раствора соли Mg2+ и 1 каплю аммиачного буферного раствора (рН 9). Рядом наносят 1 каплю раствора Na2HPO4 и наблюдают образовавшиеся кристаллы под микроскопом.
8-гидроксихинолин C9H6NOH

зеленовато-жёлтый кристаллический
В пробирку вносят 2-3 капли раствора соли Mg2+ и столько же аммиачного буферного раствора рН 9 (либо добавляют 2 капли 2М NH3 и по каплям раствор NH4Cl до растворения образовавшегося осадка). Затем в пробирку вносят несколько капель раствора 8-гидроксихинолина (при использовании спиртового раствора реагента для того, чтобы 8-гидроксихинолин при смешивании растворов не выпал в осадок, содержимое пробирки нагревают).
4. Реакция Петрашеня
Mg2+ + 2OH- + I2 Mg(OH)2 nI2
красно-бурый
В пробирку вносят 5 капель раствора I2, добавляют по каплям раствор NaOH до исчезновения окраски и затем 5 капель раствора соли Mg2+.
Реакции ионов Mn2+
1. Действие щелочей
Mn2+ + 2OH- Mn(OH)2
белый
Образующийся осадок растворим в кислотах и нерастворим в щелочах. На воздухе быстро буреет из-за окисления Mn2+ до Mn(IV).
2. Сульфид натрия
Mn2+ + S2- MnS
желтовато-розовый
Осадок растворим в кислотах.
3. Висмутат натрия NaBiO3
2Mn2+ + 5NaBiO3 + 14H+ 2MnO4- + 5Bi3+ + 5Na+ + 7H2O
малиново-фиолетовое окрашивание раствора
В пробирку вносят несколько капель раствора соли Mn2+, прибавляют 1-2 мл 2 М HNO3, несколько крупинок NaBiO3 и перемешивают.
4. Бензидин C12Н8(NH2)2
В основе реакции лежит окисление Mn2+ до Mn(IV) кислородом воздуха в щелочной среде. Образовавшийся MnO(OH)2 окисляет бензидин до окрашенного хинонимина.
Mn2+ + NH3 + H2O Mn(OH)2 + NH4+
2Mn(OH)2 + O2 2MnO(OH)2

На фильтровальную бумажку наносят 1 каплю раствора соли Mn2+. Обрабатывают парами NH3 (пятно буреет). Затем действуют 1 каплей раствора ацетата бензидина (пятно синеет).
Реакции ионов Fe2+
1. Действие щелочей
Fe2+ + 2OH- Fe(OH)2
грязно-зелёный
При осаждении без доступа воздуха выпадает осадок белого цвета. Грязно-зелёная окраска обусловлена его частичным окислением. Осадок Fe(OH)2 растворим в кислотах.
2. Сульфид натрия
Fe2+ + S2- FeS
чёрный
Осадок растворим в минеральных кислотах.
3. Гексацианоферрат (III) калия K3[Fe(CN)6]
Fe2+ + K+ + [Fe(CN)6]3- KFe[Fe(CN)6]
синий
или Fe2+ + [Fe(CN)6]3- [Fe2(CN)6]-
Образующийся осадок нерастворим в кислотах, разрушается щелочами. Он имеет такой же состав, как и продукт взаимодействия Fe3+ с [Fe(CN)6]4- (см. ниже).
4. Диметилглиоксим

При действии окислителей, например H2O2, ионы Fe2+ окисляются до Fe3+, и красная окраска исчезает.
К нескольким каплям раствора соли Fe2+ добавляют несколько капель раствора диметилглиоксима и раствора NH3.
Реакции ионов Fe3+
1. Действие щелочей
Fe3+ + 3OH- Fe(OH)3
красно-бурый
Осадок растворяется в кислотах
2. Сульфид натрия
2Fe3+ + 3S2- 2FeS + S
чёрный
Ион Fe3+ обладает окислительными свойствами, а S2- - восстановительными. Продуктами реакции являются FeS и коллоидная сера.
3. Гексацианоферрат (II) калия K4[Fe(CN)6]
Fe3+ + K+ + [Fe(CN)6]4- KFe[Fe(CN)6]
синий
или Fe3+ + [Fe(CN)6]4- [Fe2(CN)6]-
Осадок нерастворим в кислотах, разрушается щелочами. Он имеет такой же состав, как и продукт реакции Fe2+ + [Fe(CN)6]3-.
4. Тиоцианат калия или аммония (KSCN, NH4SCN)
Fe3+ + nSCN- [Fe(SCN)n]3-n
кроваво-красный
При добавлении к продукту реакции фторидов, оксалатов, цитратов, фосфорной кислоты и других веществ, образующих с Fe3+ неокрашенные комплексы, окраска раствора исчезает.
К нескольким каплям раствора соли Fe3+ прибавляют несколько капель раствора тиоцианата, а затем с помощью лопаточки твёрдый NaF до исчезновения окраски.
