- •Раздел 1
- •Занятие 1
- •Цель занятия
- •Карбонаты щелочных металлов
- •Отделение ионов аммония
- •Действие щелочей и аммиака
- •Оксалат аммония
- •Родизонат натрия (или калия)
- •Занятие 2
- •Цель занятия
- •1. На чем основано разделение катионов согласно кислотно-основной классификации?
- •2. В какой строке перечислены все групповые реагенты, используемые в кислотно-основной схеме анализа?
- •Цель занятия
- •Цель занятия
- •Салициловая кислота (сульфосалициловая кислота)
- •Цель занятия
- •1. В растворе присутствуют hCl (0,1 моль/л) и h3bo3 (0,01 моль/л). Что можно сказать о рН данного раствора?
- •Действие щелочей
- •Действие щелочей
- •Действие щелочей
- •Гексацианоферрат (II) калия
- •Цель занятия
- •1. Что из перечисленного ниже верно? Гидроксиды алюминия, цинка, хрома (III) растворимы в:
- •5. Найдите ряд, в котором содержится больше всего катионов, выпадающих в осадок в виде гидроксидов и оксосолей при обработке анализируемого раствора избытком 6 м NaOh и 6 м nh3.
- •Цель занятия
- •5. Обнаружение анионов scn- и I-
- •Цель занятия
- •Занятие 9
- •Цель занятия
- •1. В насыщенном водном растворе какого из перечисленных ниже веществ равновесная концентрация ионов металла будет наименьшей (в скобках приведены значения ks)?
- •Занятие 10
- •Цель занятия
- •1. Какие из перечисленных ниже процессов невозможны (дайте ответ, не проводя расчётов)?
- •2. Какая из частиц, выделенных полужирным шрифтом, является самым сильным окислителем?
- •3. Какая из частиц, выделенных полужирным шрифтом, является самым сильным восстановителем?
- •7. Какой из малорастворимых электролитов, формулы которых приведены ниже, обладает самым малым произведением растворимости?
- •9. Вывод об отсутствии какого ряда анионов можно сделать, если известно, что при добавлении к анализируемому раствору разбавленного раствора сильной кислоты не происходит выделения пузырьков газа?
- •10. При добавлении к анализируемому раствору ki в кислой среде не происходит появления бурой окраски вследствие выделения иода. Все анионы какого ряда можно не искать при дальнейшем анализе?
- •Занятие 11
- •Цель занятия
- •Предварительные испытания
- •Занятие 12
- •Цель занятия
- •4. Какой из приведенных ниже графиков отражает зависимость константы распределения предельных монокарбоновых кислот между хлороформом и водой в зависимости от числа атомов углерода в молекуле кислоты?
- •2. Экстракция диметилглиоксиматов никеля и кобальта
- •3. Экстракция соединения комплексного аниона [SbCl6]- с малахитовым зеленым
- •4. Экстракционное разделение I- и Br-
- •5. Экстракция ионного ассоциата берберина с трихлорацетат-анионом
- •6. Экстракция ионного ассоциата димедрола с метиловым оранжевым
- •Раздел 2
Цель занятия
Знать теоретический материал тем «Предмет и задачи аналитической химии», «Химическое равновесие в аналитической химии», «Протолитические равновесия», а также алгоритм решения типовых расчётных задач.
Уметь применять бумажную хроматографию для обнаружения неорганических веществ.
Предмет аналитической химии. Аналитическая служба.
Принцип, метод и методика анализа. Виды анализа. Методы аналитической химии.
Аналитические реакции. Важнейшие характеристики аналитической реакции (избирательность, предел обнаружения).
Систематический метод анализа.
Дробный метод анализа. Способы устранения мешающего влияния ионов.
Общая характеристика химического равновесия. Константа химического равновесия. Виды констант химического равновесия, используемые в аналитической химии.
Активность и коэффициент активности. Ионная сила раствора. Зависимость активности сильного электролита от ионной силы раствора.
Общие принципы расчёта состава равновесных систем. Общая и равновесная концентрации, молярная доля формы вещества. Уравнения материального баланса и электронейтральности. Понятие о способах графического описания равновесий.
Важнейшие теории кислот и оснований.
Количественное описание силы кислот и оснований
Влияние растворителя на кислотно-основные свойства растворённого вещества. Протонные и апротонные растворители. Классификация растворителей по кислотно-основным свойствам и полярности. Автопротолиз растворителя.
Нивелирующее и дифференцирующее действие растворителя. Сильные и слабые кислоты и основания.
Водородный показатель. Расчёт рН водных растворов сильных и слабых кислот, а также смесей нескольких кислот.
Расчёт рН водных растворов сильных и слабых оснований, амфолитов и смесей нескольких оснований.
Расчёт состава равновесных смесей протолитов при заданном значении рН
Кислотно-основные буферные растворы. Общая характеристика. Принцип действия.
Расчёт рН буферного раствора. Буферная ёмкость.
ПРИМЕНЕНИЕ БУМАЖНОЙ ХРОМАТОГРАФИИ ДЛЯ ОБНАРУЖЕНИЯ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ
1. Обнаружение катионов Сu2+ и Zn2+
В пробирку вносят 2-3 капли раствора соли меди и 4-5 капель раствора соли цинка. На бумагу, пропитанную 5% раствором тиомочевины, помещают 1 каплю приготовленной смеси растворов солей и через некоторое время, когда раствор впитается, в центр пятна помещают 1-2 капли воды, которая играет роль подвижной фазы. Хроматограмму проявляют 0,5% раствором дитизона в хлороформе. В центре образуется грязно-фиолетовое пятно, соответствующее ионам меди, ионы цинка образуют розовую зону на периферии.

2. Обнаружение катионов Сu2+ и Bi3+
В пробирку вносят 2-3 капли раствора соли меди и 4-5 капель раствора соли висмута. На бумагу, пропитанную 5% раствором тиомочевины, помещают 1 каплю приготовленной смеси растворов солей, затем смачивают 1-2 каплями воды. Хроматограмму проявляют 0,5% раствором дитизона в хлороформе. В центре образуется грязно-фиолетовое пятно, соответствующее катионам меди, а ионы висмута образуют жёлтую зону на периферии.

3. Обнаружение катионов Сd2+ , Ni2+ и Zn2+
В пробирку вносят по 2-3 капли растворов солей цинка, кадмия и никеля. На бумагу, пропитанную 5% раствором тиомочевины, помещают 1 каплю приготовленной смеси растворов солей, смачивают 1-2 каплями воды. Хроматограмму проявляют 0,5% раствором дитизона в хлороформе. В центре образуется оранжевая зона, соответствующая ионам кадмия. Находящаяся на периферии серая зона соответствует ионам никеля. Красная зона, находящаяся в середине, соответствует ионам цинка.
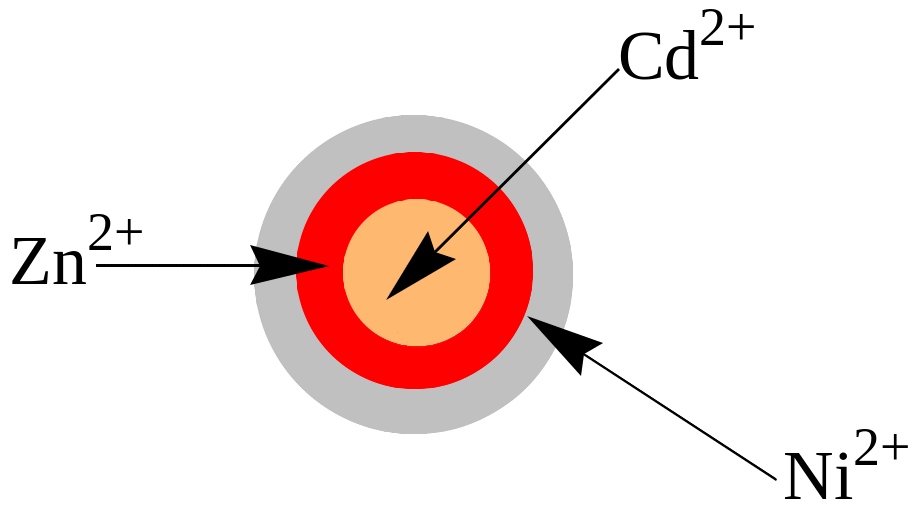
4. Обнаружение катионов Bi3+, Ni2+ и Hg22+
В пробирку вносят по 2-3 капли растворов солей висмута, ртути (I) и никеля. На бумагу, пропитанную 5% раствором тиомочевины, помещают 1 каплю полученной смеси растворов солей, смачивают 1-2 каплями воды, высушивают на воздухе и обрабатывают аммиаком, для чего подносят её на 2-3 секунды к отверстию склянки с 2 М NH3. В центре образуется черная зона, соответствующая ионам ртути, за ней - желтая зона, соответствующая ионам висмута. Для обнаружения никеля проводят по краю хроматограммы кисточкой, смоченной раствором диметилглиоксима. В присутствии ионов никеля появляется красное окрашивание.