
- •Раздел 1
- •Занятие 1
- •Цель занятия
- •Карбонаты щелочных металлов
- •Отделение ионов аммония
- •Действие щелочей и аммиака
- •Оксалат аммония
- •Родизонат натрия (или калия)
- •Занятие 2
- •Цель занятия
- •1. На чем основано разделение катионов согласно кислотно-основной классификации?
- •2. В какой строке перечислены все групповые реагенты, используемые в кислотно-основной схеме анализа?
- •Цель занятия
- •Цель занятия
- •Салициловая кислота (сульфосалициловая кислота)
- •Цель занятия
- •1. В растворе присутствуют hCl (0,1 моль/л) и h3bo3 (0,01 моль/л). Что можно сказать о рН данного раствора?
- •Действие щелочей
- •Действие щелочей
- •Действие щелочей
- •Гексацианоферрат (II) калия
- •Цель занятия
- •1. Что из перечисленного ниже верно? Гидроксиды алюминия, цинка, хрома (III) растворимы в:
- •5. Найдите ряд, в котором содержится больше всего катионов, выпадающих в осадок в виде гидроксидов и оксосолей при обработке анализируемого раствора избытком 6 м NaOh и 6 м nh3.
- •Цель занятия
- •5. Обнаружение анионов scn- и I-
- •Цель занятия
- •Занятие 9
- •Цель занятия
- •1. В насыщенном водном растворе какого из перечисленных ниже веществ равновесная концентрация ионов металла будет наименьшей (в скобках приведены значения ks)?
- •Занятие 10
- •Цель занятия
- •1. Какие из перечисленных ниже процессов невозможны (дайте ответ, не проводя расчётов)?
- •2. Какая из частиц, выделенных полужирным шрифтом, является самым сильным окислителем?
- •3. Какая из частиц, выделенных полужирным шрифтом, является самым сильным восстановителем?
- •7. Какой из малорастворимых электролитов, формулы которых приведены ниже, обладает самым малым произведением растворимости?
- •9. Вывод об отсутствии какого ряда анионов можно сделать, если известно, что при добавлении к анализируемому раствору разбавленного раствора сильной кислоты не происходит выделения пузырьков газа?
- •10. При добавлении к анализируемому раствору ki в кислой среде не происходит появления бурой окраски вследствие выделения иода. Все анионы какого ряда можно не искать при дальнейшем анализе?
- •Занятие 11
- •Цель занятия
- •Предварительные испытания
- •Занятие 12
- •Цель занятия
- •4. Какой из приведенных ниже графиков отражает зависимость константы распределения предельных монокарбоновых кислот между хлороформом и водой в зависимости от числа атомов углерода в молекуле кислоты?
- •2. Экстракция диметилглиоксиматов никеля и кобальта
- •3. Экстракция соединения комплексного аниона [SbCl6]- с малахитовым зеленым
- •4. Экстракционное разделение I- и Br-
- •5. Экстракция ионного ассоциата берберина с трихлорацетат-анионом
- •6. Экстракция ионного ассоциата димедрола с метиловым оранжевым
- •Раздел 2
Действие щелочей
Cu2+ + 2OH- Cu(OH)2
голубой
При нагревании осадок чернеет:
Cu(OH)2 CuO + H2O
чёрный
Гидроксид меди (II) растворяется в кислотах и при нагревании в концентрированных растворах щелочей.
2. Аммиак
2Cu2+ + SO42- + 2NH3 + 2H2O (CuOH)2SO4 + 2NH4+
голубовато-зелёный
При дальнейшем добавлении аммиака осадок растворяется:
(CuOH)2SO4 + 8NH3 2[Cu(NH3)4]2+ + 2OH- + SO42-
синий
При подкислении раствора комплексное соединение разрушается, и окраска раствора переходит в голубую.
3. Иодид калия

Рубеановодородная кислота (дитиооксамид)
Рубеановодородная кислота образует прочные внутрикомплексные соединения со многими ионами металлов, сульфиды которых плохо растворимы в воде. В кристаллическом состоянии реагент находится в тионной форме, в растворе - в виде смеси таутомеров. С ионами металлов реагирует тиольная форма.

Возможная формула продукта взаимодействия ионов Cu2+ с рубеановодородной кислотой выглядит следующим образом:

На фильтровальную бумажку наносят 1 каплю нейтрального раствора соли Cu2+, выдерживают некоторое время над открытой склянкой с концентрированным раствором NH3 и прибавляют 1 каплю 1% спиртового раствора реагента.
5. Тиосульфат натрия
При смешивании водных растворов, содержащих Cu2+ и S2O32- образуется бесцветный комплекс:
Сu2+ + 2S2O32- [Cu(S2O3)2]2-
При нагревании подкисленного раствора соли Cu2+ c раствором Na2S2O3 протекает окислительно-восстановительная реакция:
2Cu2+ + 2S2O32- + 2H2O Cu2S + S + 2SO42- + 4H+
тёмно-бурый
В пробирку вносят 3-4 капли раствора соли Cu2+, добавляют 1-2 капли раствора H2SO4, несколько кристалликов Na2S2O3 и нагревают.
6. Гексацианоферрат (II) калия
2Сu2+ + [Fe(CN)6]4- Cu2[Fe(CN)6]
коричнево-красный
Реакцию проводят в нейтральной или слабокислой среде. Осадок растворим в растворе NH3, разрушается щелочью.
Реакции ионов Сo2+
Действие щелочей
Co2+ + NO3- + OH- Co(OH)NO3
синий
При добавлении избытка щелочи или нагревании окраска осадка изменяется от синей к розовой:
Co(OH)NO3 + OH- Co(OH)2 + NO3-
розовый
На воздухе окраска осадка затем постепенно изменяется до тёмно-бурой вследствие окисления Co(OH)2 до Co(OH)3.
2. Аммиак
Co2+ + NO3- + NH3 + H2O Co(OH)NO3 + NH4+
синий
При дальнейшем добавлении аммиака осадок растворяется:
Co(OH)NO3 + 6NH3 [Co(NH3)6]2+ + OH- + NO3-
грязно-жёлтый
На воздухе [Co(NH3)6]2+ постепенно окисляется до [Co(NH3)6]3+, имеющего красноватую окраску
3. Тиоцианат калия или аммония
Co2+ + 4SCN- [Co(SCN)4]2-
синий
Для проведения реакции необходим избыток SCN- ионов, так как образующийся комплекс неустойчив. Проведению реакции мешают ионы Fe3+. Комплекс экстрагируется амиловым спиртом и некоторыми другими органическими растворителями.
В пробирку вносят 2 капли раствора соли Co2+, 8 капель насыщенного раствора KSCN, 0,5 мл амилового спирта и перемешивают.
4. Рубеановодородная кислота
Возможный состав образующегося продукта - см. Cu2+
На фильтровальную бумажку наносят по 1 капле раствора соли Co2+ и 1% спиртового раствора реагента. Образуется коричневое пятно или кольцо.
5. Тетрароданомеркурат аммония (NH4)2[Hg(SCN)4]
Сo2+ + [Hg(SCN)4]2- Co[Hg(SCN)4]
синий
Ионы Zn2+ ускоряют образование данного осадка.
Методику проведения реакции см. реакции ионов Zn2+
6. -нитрозо--нафтол
Вначале реагент окисляет Co2+ до Co3+, а затем образует с последним внутрикомплексное соединение
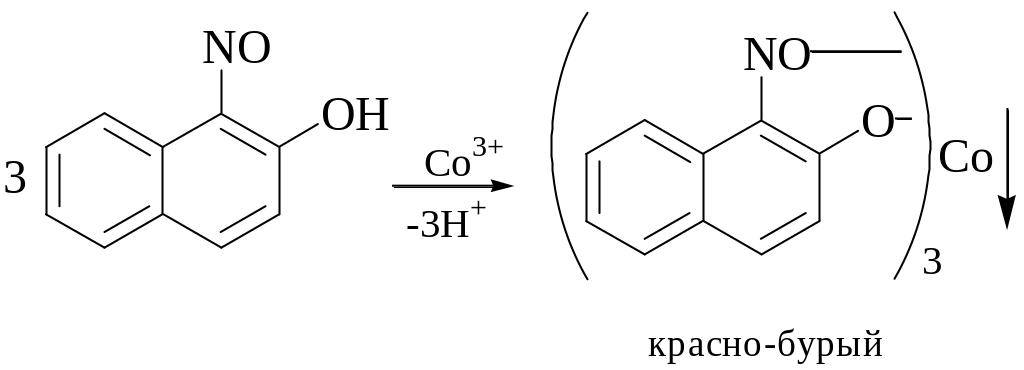
Осадок не растворяется в минеральных кислотах.
К 2-3 каплям нейтрального или слабокислого раствора соли Co2+ (к сильнокислому раствору добавляют CH3COONa) добавляют несколько капель воды, 2-3 капли раствора реагента и нагревают.
Реакции ионов Ni2+
1. Действие щелочей
Ni2+ + 2OH- Ni(OH)2
зелёный
Осадок растворим в кислотах.
2. Аммиак
Ni2+ + NO3- + NH3 + H2O Ni(OH)NO3 + NH4+
зелёный
При дальнейшем добавлении аммиака осадок растворяется:
Ni(OH)NO3 + 6NH3 [Ni(NH3)6]2+ + NO3- + OH-
синий
3. Диметилглиоксим

Осадок растворим в сильных кислотах и щелочах.
1. В пробирку вносят по 3-4 капли раствора соли Ni2+ и 2М NH3 и прибавляют 1 каплю раствора диметилглиоксима.
2. На фильтровальную бумажку наносят по 1 капле растворов соли Ni2+ и диметилглиоксима. Бумажку некоторое время выдерживают над открытой склянкой с раствором NH3.
4. Рубеановодородная кислота
Возможный состав образующегося продукта - см. с. 55.
На фильтровальную бумажку наносят 1 каплю раствора соли Ni2+, выдерживают некоторое время над открытой склянкой с концентрированным раствором NH3 и прибавляют 1 каплю 1% спиртового раствора реагента. В зависимости от содержания никеля образуется пятно от синего до сине-фиолетового цвета.
Реакции ионов Сd2+
