
- •Методические указания занятия № 1 для студентов I курса фармацевтического факультета
- •Целевые задачи:
- •Вопросы для самоподготовки:
- •Контрольные вопросы и задачи
- •Методические указания занятия № 2 для студентов I курса фармацевтического факультета
- •Лабораторная работа Материальное обеспечение:
- •Опыт№ 1. Получение и свойства гидроксида магния
- •Опыт № 2. Свойства солей магния
- •1. Реакции с раствором серной кислоты
- •2. Реакции с карбонатами
- •1. Реакция с гидрофосфатом натрия (фармакопейная)
- •2. Реакция с оксихинолином (с9h6onh)
- •3. Окрашивание пламени (фармакопейная)
- •Методические указания занятия № 3 для студентов I курса фармацевтического факультета
- •Целевые задачи:
- •Лабораторная работа Материальное обеспечение:
- •1. Реакция с раствором гидроксида аммония
- •2. Реакция с пероксидом водорода
- •3. Реакция с персульфатом аммония
- •Методические указания занятия № 4 для студентов I курса фармацевтического факультета
- •Целевые задачи:
- •К занятию повторить:
- •Лабораторная работа
- •1. Реакция с гидроксидом аммония
- •3. Реакция окисления персульфатом аммония (фармакопейная)
- •4. Микрокристаллоскопическая реакция со щавелевой кислотой
- •5. Реакция с пероксидом водорода на ион MnO4- (фармакопейная)
- •Методические указания занятия № 5 для студентов I курса фармацевтического факультета
- •Лабораторная работа
- •1. Реакция с гексацианоферратом (III) калия (фармакопейная)
- •2. Реакция с диметилглиоксимом (реактивом Чугаева)
- •1. Реакция с гексацианоферратом (II) калия (фармакопейная)
- •2. Реакция с тиоцианатом аммония
- •1. Реакция с тиоцианатом аммония
- •2. Реакция с нитрозо-р-солью (фармакопейная)
- •1. Реакция с диметилглиоксимом
- •Методические указания занятия № 6 для студентов I курса фармацевтического факультета
- •Методические указания занятия № 7 для студентов I курса фармацевтического факультета
- •Целевые задачи:
- •Вопросы для самоподготовки:
- •Лабораторная работа Материальное обеспечение:
- •1. Реакция с гидроксидом аммония (фармакопейная)
- •2. Реакция восстановления катиона меди (II) до металлической меди (фармакопейная)
- •3. Реакция с рубеановодородной кислотой
- •Методические указания занятия № 8 для студентов I курса фармацевтического факультета
- •1.Реакция с сульфидом натрия.
- •2.Реакция с тиомочевиной.
- •4.Реакция с иодидом калия.
- •1.Восстановление до металлической ртути хлоридом олова(II).
- •2. Восстановление до металлической ртути медью.
- •3.Реакция с иодидом калия.
- •4.Реакция с хроматом калия.
- •2.Реакция с иодидом калия.
- •3.Реакция восстановления катионов ртути(II) до металлической.
- •4.Реакция с дифенилкарбазидом.
- •Контрольные вопросы и задачи
- •Методические указания занятия № 9 для студентов I курса фармацевтического факультета
- •Лабораторная работа:
- •1. Реакция с ализарином.
- •Аналитические реакции на анион b4o72-
- •1. Реакция с хлоридом бария.
- •2.Окрашивание пламени сложных эфиров борной кислоты (фармакапейная).
- •3.Реакция с куркумином (фармакапейная).
- •Контрольные вопросы
- •Методические указания занятия № 11 для студентов I курса фармацевтического факультета
- •Лабораторная работа
- •Аналитические реакции на ион (co32-):
- •1. Реакция с хлоридом бария.
- •2. Реакция с сильными кислотами (фармакопейная).
- •Аналитические реакции на ион scn-:
- •1. Реакция с нитратом серебра.
- •2. Реакция с солями железа (III).
- •1. Реакция с серной кислотой или растворимыми сульфатами.
- •2. Реакция с хроматом калия.
- •3. Реакция с иодидом калия или натрия (реакция «золотого дождя», фармакопейная).
- •2. Реакция с сульфидом натрия.
- •3. Реакция с водой.
- •Контрольные вопросы:
- •Лабораторная работа
- •Аналитические реакции на ион no2-
- •Аналитические реакции на ион no3-
- •1. Реакция с металлическим цинком или алюминием.
- •2. Реакция с медью и серной кислотой (фармакопейная).
- •3. Реакция с дифениламином (фармакопейная).
- •4. Реакция с хлоридом железа (II).
- •Аналитические реакции на ион no3-
- •1. Реакция разложения солей аммония щелочами (фармакопейная).
- •2. Реакция с реактивом Несслера.
- •Методические указания занятия № 13 для студентов I курса фармацевтического факультета
- •Вопросы для самоподготовки
- •Лабораторная работа
- •Аналитические реакции на анион po43-
- •1. Реакция с нитратом серебра (фармакопейная).
- •2. Реакция с молибдатом аммония.
- •3. Реакция с магнезиальной смесью (фармакопейная).
- •1. Реакция гидролиза.
- •2. Реакция с метиловым фиолетовым.
- •Реакция гидролиза.
- •Методические указания занятия № 14 для студентов I курса фармацевтического факультета
- •Методические указания занятия № 15 для студентов I курса фармацевтического факультета
- •2. Изучить окислительно-восстановительные свойства пероксида водорода.
- •Лабораторная работа
- •2. Реакция с нитратом серебра.
- •3. Реакция с сильными минеральными кислотами.
- •4. Реакция с иодом.
- •Методические указания занятия № 16 для студентов I курса фармацевтического факультета
- •1. Реакция с нитратом серебра (фармакопейная).
- •2. Реакция с сильными окислителями.
- •Список литературы
- •Методические указания занятия № 17 для студентов I курса фармацевтического факультета
Лабораторная работа Материальное обеспечение:
Оборудование: Штатив с пробирками, спиртовка, пробиркодержательпипетки, стеклянные палочки, резиновые груши, микроскоп, предметные стёкла
Реактивы: Растворы солей магния, кальция, стронция, бария, сухие соли кальция, стронция, бария, растворы кислот и щелочей, карбоната натрия, оксалата аммония, «гипсовая вода», хромата и дихромата калия, ацетата натрия.
Опыт№ 1. Получение и свойства гидроксида магния
Получите гидроксид магния действием гидроксида аммония на соль магния. Обратите внимание на цвет осадка. Напишите уравнение реакции в молекулярном и ионном виде. Разделите осадок на две пробирки. Испытайте его отношение к раствору хлороводородной кислоты, избытку гидроксида аммония и хлориду аммония. Сделайте вывод о химическом характере гидроксида магния. Напишите уравнения реакций в молекулярном и ионном виде. Объясните причину растворения осадка в хлориде аммония. Можно ли растворить осадок гидроксида магния добавлением к нему раствора хлорида натрия?
Опыт № 2. Свойства солей магния
К раствору соли магния добавьте раствор карбоната натрия до выпадения осадка. Каков его цвет? Напишите уравнение реакции в молекулярном и ионном виде. Добавьте
в пробирку раствор хлорида аммония. Что наблюдается? Напишите математическое выражение константы растворимости карбоната магния. Объясните причину растворения осадка в растворе хлорида аммония. Напишите уравнение реакции.
Аналитические реакции на катионы Ca2+, Sr2+, Ba2+
ОПЫТ №3.
1. Реакции с раствором серной кислоты
В три пробирки помещают по 3-4 капли растворов солей бария, стронция и кальция и прибавляют 3-4 капли 2 моль/л раствора серной кислоты. Наблюдают образование белых кристаллических осадков.
Ca2+ + SO42- → CaSO4(т)
Sr2+ + SO42- → SrSO4(т)
Ba2+ + SO42- → BaSO4(т)
Проверяют растворимость полученных осадков в 2 моль/л растворах хлороводородной кислоты и гидроксида калия. Осадки не растворяются.
2. Реакции с карбонатами
В три пробирки помещают по 3-4 капли растворов солей бария, стронция, кальция и прибавляют по 3-4 капли раствора карбоната натрия. Наблюдают образование белых осадков.
Ca2+ + CO32- → CaCO3(т)
Sr2+ + CO32- → SrCO3(т)
Ba2+ + CO32- → BaCO3(т)
Проверяют растворимость полученных осадков в 2 моль/л растворах хлороводородной и уксусной кислоты. Осадки растворяются.
АНАЛИТИЧЕСКИЕ РЕАКЦИИ НА КАТИОН Mg2+
1. Реакция с гидрофосфатом натрия (фармакопейная)
К 1 мл раствора соли магния прибавляют 1 мл раствора хлорида аммония, 0,5 мл раствора фосфата натрия и 1 мл раствора аммиака. Образуется белый кристаллический осадок.
Mg2+ + HPO42- + NH3 x H2O → Mg NH4PO4 (т) + H2O
Проверяют растворимость осадка в уксусной кислоте.
2. Реакция с оксихинолином (с9h6onh)
К 3-4 каплям раствора прибавляют 3-4 капли аммиачного буферного раствора и 3 капли 5% спиртового раствора 8-оксихинолина. Наблюдают образование зеленовато-желтого кристаллического осадка оксихинолята магния.






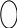
 2 + Mg2+
=
2 + Mg2+
=
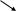
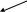 N
N
N
N
N
N

 ОН
O Mg
O
ОН
O Mg
O
АНАЛИТИЧЕСКИЕ РЕАКЦИИ НА КАТИОН Ca2+
1. Реакция с оксалатом аммония (ФАРМАКОПЕЙНАЯ)
В пробирку помещают 3 капли раствора соли кальция, добавляют 3 капли раствора оксалата аммония. Наблюдают образование белого осадка.
Ca2+ + C2O42- → CaC2O4(т)
Проверяют растворимость полученного осадка в 2 моль/л растворе уксусной кислоты. Осадок не растворяется. Ионы Sr2+, Ba2+ мешают проведению реакции.
2. Окрашивание пламени (ФАРМАКОПЕЙНАЯ)
Летучие соли кальция окрашивают пламя в кирпично-красный цвет.
АНАЛИТИЧЕСКИЕ РЕАКЦИИ НА КАТИОН Sr2+
1. Реакция с « гипсовой водой» (насыщ. Р-ром сульфата кальция CaSO4 x 2H2O)
В пробирку помещают 4 капли раствора соли стронция, добавляют 5-6 капель “гипсовой воды”, нагревают на водяной бане , и оставляют на 10-15 мин. Появляется белый осадок.
Sr2+ + CaSO4 → Sr SO4 (т) + Ca2+
2. Окрашивание пламени
Летучие соли стронция окрашивают пламя в карминово-красный цвет.
АНАЛИТИЧЕСКИЕ РЕАКЦИИ НА КАТИОН Ва2+
1. Реакция с хроматом калия
В пробирку помещают 5 капель раствора хлорида бария или нитрата бария, добавляют 5 капель раствора хромата калия. Наблюдают образование желтого осадка.
Ва2+ + CrO42- → BaCrO4(т)
Проверяют растворимость полученного осадка в 2 моль/л растворе уксусной кислоты и сильных кислотах. Осадок хромата бария растворим в сильных кислотах, но нерастворим в уксусной кислоте.
2. Реакция с дихроматом калия
В пробирку помещают 5 капель раствора соли бария, добавляют 5 капель раствора дихромата калия и 4-5 капель раствора ацетата натрия. Наблюдают образование желтого кристаллического осадка.
2Ва2+ + Cr2O72- + 2CH3COO- + H2O → 2BaCrO4(т) + 2CH3COOH
В водном растворе дихромата калия существует равновесие :
Cr2O72- + H2O ↔ 2CrO42- + 2H+
В присутствии иона бария выпадает осадок желтого цвета BaCrO4, поскольку Кs(BaCrO4) меньше Ks(BaCr2O7). Добавление ацетат-иона способствует полноте выделения осадка хромата бария. Реакция с дихроматом калия в присутствии ацетата натрия специфична для ионов бария и позволяет обнаружить его в присутствии ионов кальция и стронция.
