
- •Методические указания занятия № 1 для студентов I курса фармацевтического факультета
- •Целевые задачи:
- •Вопросы для самоподготовки:
- •Контрольные вопросы и задачи
- •Методические указания занятия № 2 для студентов I курса фармацевтического факультета
- •Лабораторная работа Материальное обеспечение:
- •Опыт№ 1. Получение и свойства гидроксида магния
- •Опыт № 2. Свойства солей магния
- •1. Реакции с раствором серной кислоты
- •2. Реакции с карбонатами
- •1. Реакция с гидрофосфатом натрия (фармакопейная)
- •2. Реакция с оксихинолином (с9h6onh)
- •3. Окрашивание пламени (фармакопейная)
- •Методические указания занятия № 3 для студентов I курса фармацевтического факультета
- •Целевые задачи:
- •Лабораторная работа Материальное обеспечение:
- •1. Реакция с раствором гидроксида аммония
- •2. Реакция с пероксидом водорода
- •3. Реакция с персульфатом аммония
- •Методические указания занятия № 4 для студентов I курса фармацевтического факультета
- •Целевые задачи:
- •К занятию повторить:
- •Лабораторная работа
- •1. Реакция с гидроксидом аммония
- •3. Реакция окисления персульфатом аммония (фармакопейная)
- •4. Микрокристаллоскопическая реакция со щавелевой кислотой
- •5. Реакция с пероксидом водорода на ион MnO4- (фармакопейная)
- •Методические указания занятия № 5 для студентов I курса фармацевтического факультета
- •Лабораторная работа
- •1. Реакция с гексацианоферратом (III) калия (фармакопейная)
- •2. Реакция с диметилглиоксимом (реактивом Чугаева)
- •1. Реакция с гексацианоферратом (II) калия (фармакопейная)
- •2. Реакция с тиоцианатом аммония
- •1. Реакция с тиоцианатом аммония
- •2. Реакция с нитрозо-р-солью (фармакопейная)
- •1. Реакция с диметилглиоксимом
- •Методические указания занятия № 6 для студентов I курса фармацевтического факультета
- •Методические указания занятия № 7 для студентов I курса фармацевтического факультета
- •Целевые задачи:
- •Вопросы для самоподготовки:
- •Лабораторная работа Материальное обеспечение:
- •1. Реакция с гидроксидом аммония (фармакопейная)
- •2. Реакция восстановления катиона меди (II) до металлической меди (фармакопейная)
- •3. Реакция с рубеановодородной кислотой
- •Методические указания занятия № 8 для студентов I курса фармацевтического факультета
- •1.Реакция с сульфидом натрия.
- •2.Реакция с тиомочевиной.
- •4.Реакция с иодидом калия.
- •1.Восстановление до металлической ртути хлоридом олова(II).
- •2. Восстановление до металлической ртути медью.
- •3.Реакция с иодидом калия.
- •4.Реакция с хроматом калия.
- •2.Реакция с иодидом калия.
- •3.Реакция восстановления катионов ртути(II) до металлической.
- •4.Реакция с дифенилкарбазидом.
- •Контрольные вопросы и задачи
- •Методические указания занятия № 9 для студентов I курса фармацевтического факультета
- •Лабораторная работа:
- •1. Реакция с ализарином.
- •Аналитические реакции на анион b4o72-
- •1. Реакция с хлоридом бария.
- •2.Окрашивание пламени сложных эфиров борной кислоты (фармакапейная).
- •3.Реакция с куркумином (фармакапейная).
- •Контрольные вопросы
- •Методические указания занятия № 11 для студентов I курса фармацевтического факультета
- •Лабораторная работа
- •Аналитические реакции на ион (co32-):
- •1. Реакция с хлоридом бария.
- •2. Реакция с сильными кислотами (фармакопейная).
- •Аналитические реакции на ион scn-:
- •1. Реакция с нитратом серебра.
- •2. Реакция с солями железа (III).
- •1. Реакция с серной кислотой или растворимыми сульфатами.
- •2. Реакция с хроматом калия.
- •3. Реакция с иодидом калия или натрия (реакция «золотого дождя», фармакопейная).
- •2. Реакция с сульфидом натрия.
- •3. Реакция с водой.
- •Контрольные вопросы:
- •Лабораторная работа
- •Аналитические реакции на ион no2-
- •Аналитические реакции на ион no3-
- •1. Реакция с металлическим цинком или алюминием.
- •2. Реакция с медью и серной кислотой (фармакопейная).
- •3. Реакция с дифениламином (фармакопейная).
- •4. Реакция с хлоридом железа (II).
- •Аналитические реакции на ион no3-
- •1. Реакция разложения солей аммония щелочами (фармакопейная).
- •2. Реакция с реактивом Несслера.
- •Методические указания занятия № 13 для студентов I курса фармацевтического факультета
- •Вопросы для самоподготовки
- •Лабораторная работа
- •Аналитические реакции на анион po43-
- •1. Реакция с нитратом серебра (фармакопейная).
- •2. Реакция с молибдатом аммония.
- •3. Реакция с магнезиальной смесью (фармакопейная).
- •1. Реакция гидролиза.
- •2. Реакция с метиловым фиолетовым.
- •Реакция гидролиза.
- •Методические указания занятия № 14 для студентов I курса фармацевтического факультета
- •Методические указания занятия № 15 для студентов I курса фармацевтического факультета
- •2. Изучить окислительно-восстановительные свойства пероксида водорода.
- •Лабораторная работа
- •2. Реакция с нитратом серебра.
- •3. Реакция с сильными минеральными кислотами.
- •4. Реакция с иодом.
- •Методические указания занятия № 16 для студентов I курса фармацевтического факультета
- •1. Реакция с нитратом серебра (фармакопейная).
- •2. Реакция с сильными окислителями.
- •Список литературы
- •Методические указания занятия № 17 для студентов I курса фармацевтического факультета
Методические указания занятия № 1 для студентов I курса фармацевтического факультета
ТЕМА: S-элементы I А группы периодической системы Д.И. Менделеева и свойства их соединений. Основные понятия качественного анализа. Аналитические реакции на ионы Na+, К+.
ЦЕЛЬ: Изучить химические и аналитические свойства соединений S-элементов I А группы.
S – элементы играют важную роль в биологических системах. Они являются биогенными элементами. Водород входит в состав белков, нуклеиновых кислот. Натрий – главный внеклеточный ион, калий – внутриклеточный ион. В медицинской практике применяют препараты натрия (хлорид, бромид, иодид, гидрокарбонат, тиосульфат, нитрит, тетраборат и др.), калия ( хлорид, бромид, иодид, ацетат, оротат и др.). Натрия хлорид, калия хлорид являются незаменимыми компонентами инфузионных растворов, которые используют при больших кровопотерях и некоторых заболеваниях, связанных с обезвоживанием организма. Так, например, физиологический раствор Рингера-Локка имеет состав: Натрия хлорида 9,0
Калия хлорида 0,2
Кальция хлорида 0,2
Натрия гидрокарбоната 0,2
Глюкозы 1,0
Воды для инъекций до 1 л Препараты натрия хлорид, натрия сульфат, натрия нитрат используют для изотонирования глазных капель.
При определении подлинности лекарственных препаратов используют аналитические реакции на катионы, многие из которых являются фармакопейными.
Целевые задачи:
1.Провести реакцию гидролиза карбоната и гидрокарбоната натрия.
2.Изучить окислительно-восстановительные свойства пероксида водорода.
3.Овладеть техникой выполнения аналитических реакций полумикрометодом. Выполнить качественные реакции на ионы Na+, K+ .
Вопросы для самоподготовки:
1. Общая характеристика водорода. Особенности его положения в периодической системе элементов Д.И.Менделеева. Физические и химические свойства водорода. Реакции водорода с кислородом, галогенами, активными металлами и оксидами.
2. Вода. Строение молекулы. Физические и химические свойства. Гидроксиды, аквакомплексы, кристаллогидраты. Получение дистиллированной, апирогенной воды и применение их в фармации. Минеральные воды.
3. Пероксид водорода. Строение молекулы. Химические свойства. Окислительно-восстановительная двойственность. Применение в медицине и фармации.
4. Общая характеристика элементов IА группы. Физические и химические свойства простых веществ. Нахождение в природе, способы получения. Оксиды, пероксиды, надпероксиды их получение и свойства. Оксиды и гидроксиды, их получение и свойства. Гидриды и амиды щелочных металлов. Растворимость и термическая устойчивость солей, гидролиз.
5. Биологическая роль элементов IA группы. Химические основы применения соединений лития, натрия и калия в медицине и фармации.
6. Основные понятия качественного химического анализа. Методы анализа.
7. Аналитические свойства веществ, аналитические реакции и условия их применения.
8. Чувствительность и специфичность аналитических реакций.
9. Аналитическая классификация катионов и связь с периодической системой Д.И.Менделеева.
10. Основные правила работы, техники безопасности и оказания первой медицинской помощи при работе в химической лаборатории.
11.Аналитические реакции на катионы Na+, К+.
Лабораторная работа
Материальное обеспечение
Оборудование:
1. Штатив с пробирками.
2. Спиртовка
3. Пробиркодержатель
4. Пипетки, стеклянные палочки, груши
5. Микроскоп, предметные стёкла
Реактивы: 0,1 моль/л растворы карбоната и гидрокарбоната натрия, 3% раствор пероксида водорода, раствор перманганата калия С(1/5 КМпО4)=0,05 моль/л, 10% раствор иодида калия, раствор серной кислоты С(1/2 Н2SO4)=2 моль/л, 1% раствор крахмала, универсальный индикатор (бумага), растворы солей нитратов или хлоридов натрия, калия, сухие соли хлоридов натрия, калия, специальные реактивы: гексагидроксостибат (V) калия, цинкуранилацетат, пикриновая кислота, гексанитрокобальтат (III) натрия, гидротартрат натрия, гексанитрокупрат (II) натрия-свинца, растворы ацетата натрия, уксусной кислоты.
Опыт №1. Гидролиз карбоната и гидрокарбоната натрия
В две пробирки налейте по 1 мл 0,1 моль/л растворов карбоната и гидрокарбоната натрия, определите с помощью индикаторной бумаги реакцию среды.
Напишите уравнения гидролиза с протолитической точки зрения.
Сделайте вывод о влиянии природы электролита на степень и рН среды гидролизующейся соли.
Опыт №2. Окислительно-восстановительные свойства пероксида водорода
В две пробирки налейте по 1 мл 3% раствора пероксида водорода и 1 мл раствора серной кислоты с молярной концентрацией эквивалента 2 моль/л. В одну из пробирок прибавьте 1 мл раствора перманганата калия С (1/5 КМпО4) = 0,05 моль/л, в другую 1 мл 10% раствора иодида калия и 0,5 мл 1% раствора крахмала.
Напишите уравнения реакций и расставьте коэффиценты методом ионно-электронного баланса. Сделайте вывод об окислительно-восстановительных свойствах пероксида водорода. Мотивируйте ответ, используя значения стандартных окислительно-восстановительных потенциалов.
Оформить в виде таблицы:
Аналитические (качественные) реакции на катионы и анионы
№ п/п |
Опре-деля-емый Ион |
Реагент |
Уравнения реакций в ионном виде |
Условия проведе- ния ре- акций |
Аналити- ческий эффект |
Анализ продук-та реак- ций
|
Приме-чания |
Аналитические реакции на катион Na+
Опыт №3.
1. Реакция с гексагидроксостибатом (V) калия
5-6 капель раствора соли натрия помещают в пробирку, прибавляют 5-6 капель раствора гексагидроксостибата (V) калия и потирают о стенки пробирки стеклянной палочкой. Выпадает белый кристаллический осадок гексагидроксостибата (V) натрия.
Реакцию проводят в нейтральной среде, так как в сильно кислой среде образуется белый аморфный осадок метасурьмяной кислоты HSbO3. В щелочной среде осадок Na[Sb(OH)6] растворяется с образованием Na3[SbO4].
Ионы NH4+ мешают проведению реакции. Реакция малочувствительна.
2. Реакция с цинкуранилацетатом (фармакопейная)
1 мл раствора соли натрия подкисляют разведённой уксусной кислотой и прибавляют 0,5 мл раствора цинк-уранилацетата. Образуется жёлтый кристаллический осадок.
Zn(UO2)3(CH3COO)8 → Zn2+ + 3UO22+ + 8CH3COO -
Na+ + Zn2+ + 3UO22+ + 9CH3COO- + 9H2O → NaZn(UO2)3(CH3COO)9 х 9Н2О↓
Осадок растворим в щелочах и сильных кислотах.
Чувствительность реакции 0,01 - 0,03 г/мл.
Ионы К+; Li+; NH4+; Mg2+ мешают проведению реакции.
3. Реакция с пикриновой кислотой (2,4,6-тринитрофенолом)
На предметное стекло помещают каплю раствора соли натрия, осторожно выпаривают над пламенем спиртовки до образования белой каемки по краям капли. Стекло охлаждают и рядом помещают каплю реактива. Соединяют обе капли стеклянной палочкой. Через минуту наблюдают под микроскопом образование игольчатых кристаллов пикрата натрия.
ONa



 О-
O2N
NO2
О-
O2N
NO2
О
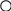 2N
NO2
2N
NO2
+ Na+ → ↓

NO2 NO2
2,4,6 - тринитрофенолят натрия
(пикрат натрия)
4.Окрашивание пламени (фармакопейная)
В петельку нихромовой проволоки помещают несколько кристаллов летучей соли натрия и вносят в бесцветное пламя спиртовки. Наблюдают окрашивание пламени в желтый цвет. Реакция высокочувствительна.
Аналитические реакции на катион К+
1.Реакция с гидротартратом натрия (NaHC4H4O6) (фармакопейная)
К 2 мл соли калия прибавляют 1мл раствора винной кислоты (H2C4H4O6), 1 мл раствора ацетата натрия, 0,5 мл 95% этанола и встряхивают. Постепенно образуется белый кристаллический осадок, растворимый в разведенных минеральных кислотах, щелочах и при нагревании.
K+ + HC4H4O6- → KHC4H4O6 ↓
Ионы аммония мешают проведению реакции.
2. Реакция с гексанитрокобальтатом (III) натрия
К 2 мл раствора соли калия прибавляют 0,5 мл разведенной уксусной кислоты и 0,5 мл раствора гексанитрокобальтата(III) натрия. Образуется желтый кристаллический осадок.
2К+ + Na+ + [Cо(NO2)6] 3- → K2Na [Co(NO2)6] ↓
Ионы аммония мешают проведению реакции.
3. Окрашивание пламени (фармакопейная)
Летучие соли калия окрашивают бесцветное пламя спиртовки в фиолетовый цвет, а при просматривании через синее стекло – в пурпурно-красный.
