
- •Методические указания занятия № 1 для студентов I курса фармацевтического факультета
- •Целевые задачи:
- •Вопросы для самоподготовки:
- •Контрольные вопросы и задачи
- •Методические указания занятия № 2 для студентов I курса фармацевтического факультета
- •Лабораторная работа Материальное обеспечение:
- •Опыт№ 1. Получение и свойства гидроксида магния
- •Опыт № 2. Свойства солей магния
- •1. Реакции с раствором серной кислоты
- •2. Реакции с карбонатами
- •1. Реакция с гидрофосфатом натрия (фармакопейная)
- •2. Реакция с оксихинолином (с9h6onh)
- •3. Окрашивание пламени (фармакопейная)
- •Методические указания занятия № 3 для студентов I курса фармацевтического факультета
- •Целевые задачи:
- •Лабораторная работа Материальное обеспечение:
- •1. Реакция с раствором гидроксида аммония
- •2. Реакция с пероксидом водорода
- •3. Реакция с персульфатом аммония
- •Методические указания занятия № 4 для студентов I курса фармацевтического факультета
- •Целевые задачи:
- •К занятию повторить:
- •Лабораторная работа
- •1. Реакция с гидроксидом аммония
- •3. Реакция окисления персульфатом аммония (фармакопейная)
- •4. Микрокристаллоскопическая реакция со щавелевой кислотой
- •5. Реакция с пероксидом водорода на ион MnO4- (фармакопейная)
- •Методические указания занятия № 5 для студентов I курса фармацевтического факультета
- •Лабораторная работа
- •1. Реакция с гексацианоферратом (III) калия (фармакопейная)
- •2. Реакция с диметилглиоксимом (реактивом Чугаева)
- •1. Реакция с гексацианоферратом (II) калия (фармакопейная)
- •2. Реакция с тиоцианатом аммония
- •1. Реакция с тиоцианатом аммония
- •2. Реакция с нитрозо-р-солью (фармакопейная)
- •1. Реакция с диметилглиоксимом
- •Методические указания занятия № 6 для студентов I курса фармацевтического факультета
- •Методические указания занятия № 7 для студентов I курса фармацевтического факультета
- •Целевые задачи:
- •Вопросы для самоподготовки:
- •Лабораторная работа Материальное обеспечение:
- •1. Реакция с гидроксидом аммония (фармакопейная)
- •2. Реакция восстановления катиона меди (II) до металлической меди (фармакопейная)
- •3. Реакция с рубеановодородной кислотой
- •Методические указания занятия № 8 для студентов I курса фармацевтического факультета
- •1.Реакция с сульфидом натрия.
- •2.Реакция с тиомочевиной.
- •4.Реакция с иодидом калия.
- •1.Восстановление до металлической ртути хлоридом олова(II).
- •2. Восстановление до металлической ртути медью.
- •3.Реакция с иодидом калия.
- •4.Реакция с хроматом калия.
- •2.Реакция с иодидом калия.
- •3.Реакция восстановления катионов ртути(II) до металлической.
- •4.Реакция с дифенилкарбазидом.
- •Контрольные вопросы и задачи
- •Методические указания занятия № 9 для студентов I курса фармацевтического факультета
- •Лабораторная работа:
- •1. Реакция с ализарином.
- •Аналитические реакции на анион b4o72-
- •1. Реакция с хлоридом бария.
- •2.Окрашивание пламени сложных эфиров борной кислоты (фармакапейная).
- •3.Реакция с куркумином (фармакапейная).
- •Контрольные вопросы
- •Методические указания занятия № 11 для студентов I курса фармацевтического факультета
- •Лабораторная работа
- •Аналитические реакции на ион (co32-):
- •1. Реакция с хлоридом бария.
- •2. Реакция с сильными кислотами (фармакопейная).
- •Аналитические реакции на ион scn-:
- •1. Реакция с нитратом серебра.
- •2. Реакция с солями железа (III).
- •1. Реакция с серной кислотой или растворимыми сульфатами.
- •2. Реакция с хроматом калия.
- •3. Реакция с иодидом калия или натрия (реакция «золотого дождя», фармакопейная).
- •2. Реакция с сульфидом натрия.
- •3. Реакция с водой.
- •Контрольные вопросы:
- •Лабораторная работа
- •Аналитические реакции на ион no2-
- •Аналитические реакции на ион no3-
- •1. Реакция с металлическим цинком или алюминием.
- •2. Реакция с медью и серной кислотой (фармакопейная).
- •3. Реакция с дифениламином (фармакопейная).
- •4. Реакция с хлоридом железа (II).
- •Аналитические реакции на ион no3-
- •1. Реакция разложения солей аммония щелочами (фармакопейная).
- •2. Реакция с реактивом Несслера.
- •Методические указания занятия № 13 для студентов I курса фармацевтического факультета
- •Вопросы для самоподготовки
- •Лабораторная работа
- •Аналитические реакции на анион po43-
- •1. Реакция с нитратом серебра (фармакопейная).
- •2. Реакция с молибдатом аммония.
- •3. Реакция с магнезиальной смесью (фармакопейная).
- •1. Реакция гидролиза.
- •2. Реакция с метиловым фиолетовым.
- •Реакция гидролиза.
- •Методические указания занятия № 14 для студентов I курса фармацевтического факультета
- •Методические указания занятия № 15 для студентов I курса фармацевтического факультета
- •2. Изучить окислительно-восстановительные свойства пероксида водорода.
- •Лабораторная работа
- •2. Реакция с нитратом серебра.
- •3. Реакция с сильными минеральными кислотами.
- •4. Реакция с иодом.
- •Методические указания занятия № 16 для студентов I курса фармацевтического факультета
- •1. Реакция с нитратом серебра (фармакопейная).
- •2. Реакция с сильными окислителями.
- •Список литературы
- •Методические указания занятия № 17 для студентов I курса фармацевтического факультета
3.Реакция с куркумином (фармакапейная).
В пробирке смешивают 3-5 капель раствора тетрабората натрия с 1-2 каплями раствора HCl и опускают в смесь куркумовую бумагу. Наблюдают окрашивание бумаги в красно-коричневый цвет. Бумагу подсушивают и вносят на нее каплю раствора гидроксида аммония, бумага изменяет окраску в синий или зеленовато-черный цвет.
Контрольные вопросы
1. Напишите электронные формулы бора и алюминия. Укажите в них валентные электроны.
2. Как изменяется характер оксидов и гидроксидов элементов периодической системы от бора к галлию? Какие факторы влияют на изменение их свойств?
3. При 400-600оС бор непосредственно соединяется с кислородом, серой, бромом. Напишите уравнения протекающих реакций и укажите, с каким из данных элементов образуется наиболее полярная связь. Ответ мотивируйте.
4. Что представляет собой по химическому составу: а) бориды, б) бораны, в) бораты. Приведите по одной формуле для каждого из этих соединений.
5. Осуществите схему превращения:
В2Н6
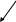
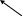

 Н3ВО3
Мg3B3
Н3ВО3
Мg3B3

 B
B
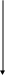
 Na
BO2 H3BO3
Na
BO2 H3BO3

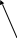
B2O3
6. Напишите уравнения реакций получения ортоборной кислоты взаимодействием тетрабората натрия с серной кислотой.
7. Можно ли получить: а) сульфид и б) карбонат алюминия обменной реакцией соответствующих солей в водном растворе? Ответ иллюстрируйте соответствующими уравнениями реакций.
8. Раствор борной кислоты спиртовый применяется как антисептическое средство в виде ушных капель. Сколько грамм борной кислоты и миллилитров спирта (ρ=0,83 г/см3) необходимо для приготовления 50г 3% спиртового раствора борной кислоты.
Список литературы
Основная и дополнительная литература :
1. Общая химия. Биофизическая химия. Химия биогенных элементов/Под ред. А.М.Ершова. – М: Высшая школа, 2002.
2.Карапетьянц М.Х. Введение в теорию химических процессов. - М: Высшая школа,1981.
3.Оганесян Э.Т. Неорганическая химия - М: Высшая школа,1984
4.Хомченко Г.П. Практикум по общей и неорганической химии с применением полумикрометода – М: Высшая школа,1980.
5. Бионеорганическая и аналитическая химия. Книга 1./ Под ред. А.И. Сичко. – Тюмень, 2000. Книга 2, 3, 4. – Тюмень, 2003.
6.Карапетьянц М.Х. Общая и неорганическая химия. – М: Химия, 1994.
7.Лурье Ю.Ю. Справочник по аналитической химии М, Химия,1983г.
8.Учебно-методические указания «Теоретические основы химии», Тюмень,1989г.
9.Учебно-методические указания «Строение вещества. Растворы. Окислительно-восстановительные реакции. Комплексные соединения», Тюмень,1989г
Методические указания занятия № 11 для студентов I курса фармацевтического факультета
ТЕМА: р-элементы IVА-группы периодической системы Д.И. Менделеева. Углерод, кремний, германий, олово, свинец и свойства их соединений. Аналитические реакции на ионы CO32-, SCN-, Sn2+, Sn4+, Pb2+.
ЦЕЛЬ: Изучить химические и аналитические свойства соединений элементов IVА-группы периодической системы Д.И. Менделеева.
ЦЕЛЕВЫЕ ЗАДАЧИ:
1. Изучить свойства гидроксида олова (II).
2. Изучить восстановительные свойства соединений олова (II).
3. Получить гидроксид свинца и изучить его свойства.
4. Изучить восстановительные свойства соединений (II).
5. Выполнить аналитические реакции на ионы CO32-, SCN-, Sn2+, Sn4+, Pb2+.
ВОПРОСЫ ДЛЯ САМОПОДГОТОВКИ:
1. Углерод. Валентные состояния и модификации углерода. Физические и химические свойства простых веществ.
2. Углерод в отрицательных степенях окисления. Карбиды активных металлов и соответствующие им углеводороды.
3. Углерод (II). Оксид углерода (II), его кислотно-основные иокислительно-восстановительные характеристики, свойства как лиганда, химические основы его токсичности. Цианистоводородная кислота, простые и комплексные цианиды. Химические основы токсичности цианидов.
4. Соединения углерода (IV). Оксид углерода (IV), стереохимия и природа связи, равновесия в водном растворе. Угольная кислота, карбонаты и гидрокарбонаты, гидролиз и термохимическое разложение.
5. Соединения углерода с галогенами и серой. Четыреххлористый углерод, фосген, фреоны, сероуглерод и тиокарбонаты. Цианаты и тиоцианаты. Физические и химические свойства, применение.
6. Биологическая роль углерода. Химические основы использования неорганических соединений углерода в медицине и фармации.
7. Кремний. Общая характеристика. Основное отличие от углерода: отсутствие -связи в соединениях.
8. Силициды. Соединения с водородом (силаны), окисление и гидролиз. Тетрафторид и тетрахлорид кремния, гидролиз. Гексафторосиликаты. Кислородные соединения. Оксид кремния (IV). Силикагель. Кремневая кислота. Силикаты. Растворимость и гидролиз. Прировные силикаты и алюмосиликаты, цеолиты. Кремнийорганические соединений. Силиконы и силоксаны. Использование в медицине соединений кремния.
9. Элементы подгруппы германия. Общая характеристика. Устойчивость водородных соединений. Соединения с галогенами типа ЭHal2 и ЭHal4, поведение в водных растворах. Оловохлористоводородная кислота. Оксиды.
10. Оксид свинца (IV) как сильный окислитель. Амфотерность гидроксидов. Растворимые и нерастворимые соли олова и свинца. ОВ реакции в растворах. Химизм токсического действия соединений свинца. Применение в медицине свинецсодержащих препаратов (свинца (II) ацетат, свинца (II) оксид). Химические основы использования соединений олова и свинца в анализе фармпрепаратов.
