
- •Міністерство освіти і науки, молоді та спорту україни
- •Одеської національної академії харчових технологій
- •Розглянуто:
- •2. Виконавець:
- •Рецензент:
- •Міністерство освіти і науки, молоді та спорту україни одеський технічний коледж одеської національної академії харчових технологій
- •Методичні вказівки до практичних робіт з предмету “Аналітична хімія” для студентів іі курсу
- •Практичне заняття № 1.
- •Стислі теоретичні відомості
- •Завдання для самоперевірки та закріплення матеріалу
- •Практичне заняття № 2.
- •Стислі теоретичні відомості
- •Завдання для самоперевірки та закріплення матеріалу
- •Практичне заняття № 3.
- •Стислі теоретичні відомості
- •Завдання для самоперевірки та закріплення матеріалу
- •Практичне заняття № 4.
- •Стислі теоретичні відомості.
- •Розрахункові формули у гравіметричному аналізі.
- •Завдання для самоперевірки та закріплення матеріалу
- •Практичне заняття № 5.
- •Стислі теоретичні відомості.
- •Завдання для самоперевірки та закріплення матеріалу
- •Практичне заняття № 6.
- •Стислі теоретичні відомості.
- •Завдання для самоперевірки та закріплення матеріалу
- •Практичне заняття № 7.
- •Стислі теоретичні відомості.
- •Завдання для самоперевірки та закріплення матеріалу
- •Практичне заняття № 8. Тема: Рішення задач в оксидиметрії.
- •Завдання для самоперевірки та закріплення матеріалу
- •Практичне заняття № 9.
- •Стислі теоретичні відомості.
- •Завдання для самоперевірки та закріплення матеріалу
- •Практичне заняття № 10.
- •Стислі теоретичні відомості.
- •Завдання для самоперевірки та закріплення матеріалу
- •Практичне заняття № 11.
- •Стислі теоретичні відомості.
- •Завдання для самоперевірки та закріплення матеріалу
- •Рекомендована література.
- •Додаток
- •Густина розчинів кон та NaOh
Завдання для самоперевірки та закріплення матеріалу
За допомогою іонно-електронного методу складіть рівняння наступих окисно-відновних реакцій:
Bi2S3 + HNO3 Bi2(SO4)3 + NO + H2O
Na2MoO4 + HCl+ Al MoCl2 + AlCl3 + NaCl + H2O
KMnO4 + NaNO2 + KOH K2MnO4 + NaNO3 + H2O
Sb2O3 + HbrO3 Sb2O5 + HBr
Fe + HNO3 Fe(NO3)2 + NH4NO3 + H2O
KMnO4 + H2O2 + H2SO4 K2SO4 + MnSO4 + O2 + H2O
Bi2O3 + Cl2 + KOH Bi2O5 + KCl + H2O
Практичне заняття № 8. Тема: Рішення задач в оксидиметрії.
Повинні знати: методику складання окисно-відновних реакцій, користування довідковими таблицями, розрахункові формули.
Повинні вміти: затвердити навики по складанню рівнянь окислювально-відновних реакцій, придбати навики по визначенню мас окисника та відновника, затвердити навики виконання розрахункових задач по оксидиметрії.
Стислі теоретичні відомості.
В оксидиметричному методі аналізу зустрічаються з трьома видами титрування: прямим, зворотнім та титруванням по заміщенню.
Особливістю цього методу являється визначення еквівалентних мас окисника та відновника.
Під еквівалентною масою слід розуміти кількість речовини в г/моль, еквівалентне одному прийнятому електрону однією молекулою окисника в даній реакції.
Е
=
![]()
де М – молярна маса окисника
n – число прийнятих електронів молекули окисника в даній реакції.
Під еквівалентною масою відновника розуміють кількість речовини в г/моль, яке еквівалентно одному відданому електрону однією молекулою відновника в даній реакції.
Е =
де М – молярна маса відновника
n – число прийнятих електронів, відданих однією молекулою відновника в даній реакції.
Всі розрахункові задачі методу оксидиметрії вирішуються з використанням усіх формул титриметичного аналізу. Цей розрахунок величини наважок окисника та відновника необхідний для їх приготування. Розрахунки, пов’язані з титруванням, проводяться з використанням закону еквівалентів.
Окисник взаємодіє з розчином відновника в об’ємах, зворотно пропорційних їх еквівалентним концентраціям. Таке титрування називають прямим.
При зворотному титруванні точний об’єм невідомого окисника обробляється точним надлишковим об’ємом відомого відновника, лишок якого відтитровується еквівалентним об’ємом відомого окисника.
При титруванні по заміщенню точний об’єм відомого окисника з розчину йодиду калію у кислому середовищі виділяє еквівалентну кількість йоду, яке відтитровується еквівалентним об’ємом розчину тіосульфату натрію.
Приклад 1. 1,2500г оксалату натрію Na2С2О4 розчинили у мірній колбі на 250 см3. На титрування 25 см3 утвореного розчину витрачається 21,2 см3 розчину перманганату КМnO4. Визначте еквівалентну молярну концентрацію КМnO4 та титр КМnO4 по залізу.
Д ано:
Рішення.
ано:
Рішення.
![]() = 1,2500 г 1. Скласти
рівняння реакції:
= 1,2500 г 1. Скласти
рівняння реакції:
V = 250 см3 2KMnO4 + 5Na2C2O4 + 8H2SO4 → Na2SO4 + 2MnSO4 +10CO2↑ + 8H20
V = 25 см3 C2O42- - 2e → 2CO2 │5
M nO4-
+ 8H+
5e → Mn2+
+ 4H2O │2
nO4-
+ 8H+
5e → Mn2+
+ 4H2O │2
Секв.
-
? Е
=
![]() г/моль
г/моль
Т
![]() - ? Е
- ? Е![]() =
=
![]() г/моль
г/моль
2. Знаходимо еквівалентну молярну концентрацію та титр оксалату:
Т
=
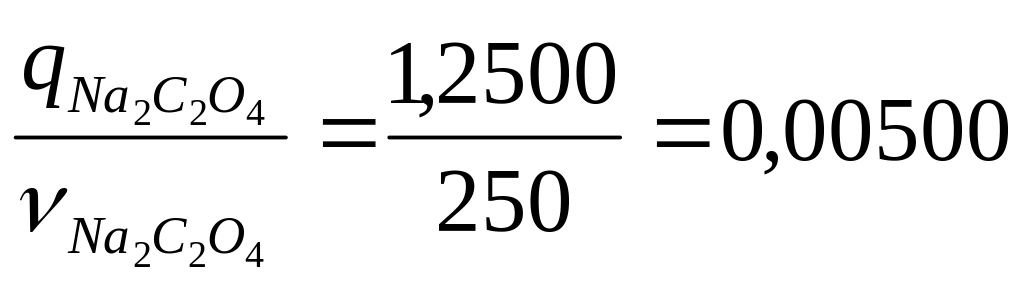 г/см3
г/см3
С
екв.
=
![]() мольекв/дм3
мольекв/дм3
3. Визначаємо еквівалентну молярну концентрацію КМnO4
Секв.
=
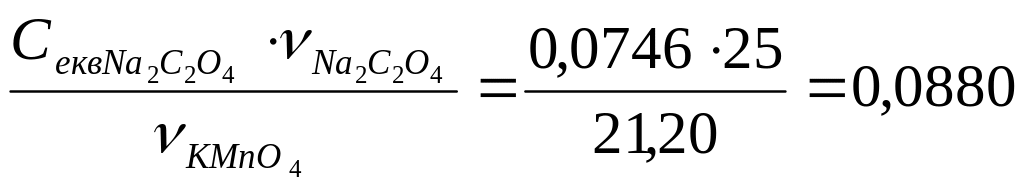 мольекв/дм3
мольекв/дм3
4.Знаходимо титр перманганату калію по залізу
Т
=
![]() г/см3
г/см3
ЕFe = 55,85 г/моль
