
- •Міністерство освіти і науки, молоді та спорту україни
- •Одеської національної академії харчових технологій
- •Розглянуто:
- •2. Виконавець:
- •Рецензент:
- •Міністерство освіти і науки, молоді та спорту україни одеський технічний коледж одеської національної академії харчових технологій
- •Методичні вказівки до практичних робіт з предмету “Аналітична хімія” для студентів іі курсу
- •Практичне заняття № 1.
- •Стислі теоретичні відомості
- •Завдання для самоперевірки та закріплення матеріалу
- •Практичне заняття № 2.
- •Стислі теоретичні відомості
- •Завдання для самоперевірки та закріплення матеріалу
- •Практичне заняття № 3.
- •Стислі теоретичні відомості
- •Завдання для самоперевірки та закріплення матеріалу
- •Практичне заняття № 4.
- •Стислі теоретичні відомості.
- •Розрахункові формули у гравіметричному аналізі.
- •Завдання для самоперевірки та закріплення матеріалу
- •Практичне заняття № 5.
- •Стислі теоретичні відомості.
- •Завдання для самоперевірки та закріплення матеріалу
- •Практичне заняття № 6.
- •Стислі теоретичні відомості.
- •Завдання для самоперевірки та закріплення матеріалу
- •Практичне заняття № 7.
- •Стислі теоретичні відомості.
- •Завдання для самоперевірки та закріплення матеріалу
- •Практичне заняття № 8. Тема: Рішення задач в оксидиметрії.
- •Завдання для самоперевірки та закріплення матеріалу
- •Практичне заняття № 9.
- •Стислі теоретичні відомості.
- •Завдання для самоперевірки та закріплення матеріалу
- •Практичне заняття № 10.
- •Стислі теоретичні відомості.
- •Завдання для самоперевірки та закріплення матеріалу
- •Практичне заняття № 11.
- •Стислі теоретичні відомості.
- •Завдання для самоперевірки та закріплення матеріалу
- •Рекомендована література.
- •Додаток
- •Густина розчинів кон та NaOh
Завдання для самоперевірки та закріплення матеріалу
Визначте еквівалентні маси вихідних речовин в реакції
H2SO4 + КOH = К2SO4 + 2Н2О
З наважки 0,6493 г щавлевої кислоти приготували 100 см3 розчину. Який його титр та концентрація?
Скільки грамів лугу NaOH необхідно взяти для приготування 250 см3 розчину з еквівалентною молярною концентрацією 0,1 моль екв/дм3.
На нейтралізацію розчину КОН витратили 25 мл 0,1 мольекв/дм3 НСІ. Скільки грамів КОН міститься в розчині?
Практичне заняття № 10.
Тема: Визначення масової частки розчинів.
Повинні знати: методику рішення задач.
Повинні вміти: користуватися довідковими таблицями, визначати масову та молярну частку.
Стислі теоретичні відомості.
Масова частка – це відношення маси компонента розчину m1 до маси розчину m2. Масова частка виражається в частках одиниці або в процентах.
% =
![]()
100,
100,
де m1 – маса розчиненої речовини;
m2 – маса розчину.
Приклад 1: В 220 г води розчинили 30 г хлориду натрію. Знайти масову частку хлориду натрію в розчині.
 Дано:
Розв’язання:
Дано:
Розв’язання:
m (H2O) = 220 г 1. Маса розчину складається з маси розчинника та маси m (NaCl) = 30 г розчиненої речовини:
 m = m (H2O)
+ m (NaCl) = 220 + 30 = 250 г
m = m (H2O)
+ m (NaCl) = 220 + 30 = 250 г
- ? 2. Знаходимо масову частку розчину:
=
![]() 100% =
100% =
![]() 100% = 12%
100% = 12%
Відповідь: масова частка NaCl в розчині 12%.
2. Молярна частка – відношення кількості розчиненої речовини (або розчинника) до суми кількостей всіх речовин, які складають розчин.
У
випадку розчину одної речовини у іншій,
молярна частка розчиненої речовини
(N2)
дорівнює: N2
=
![]() + n2
,
+ n2
,
а
молярна
частка розчинника (N1):
N1
=
![]() + n2
+ n2
де n1 та n2 – відповідно кількості розчинника розчинної речовини.
Приклад 2: Визначити мольну частку глюкози у водному розчині глюкози з масовою часткою 36%.
 Дано:
Рішення:
Дано:
Рішення:
W(C6H12O6) = 36% 1. Мольна частка речовини у розчині дорівнює відношенню
числа молів цієї речовини, до загальної кількості молів
N(C6H12O6) - ? усіх речовин, які містяться у розчині.
M(C6H12O6) = 12 ∙ 6 + 1 ∙ 12 + 16 ∙ 6 = 180г/моль.
N(C6H12O6)
=
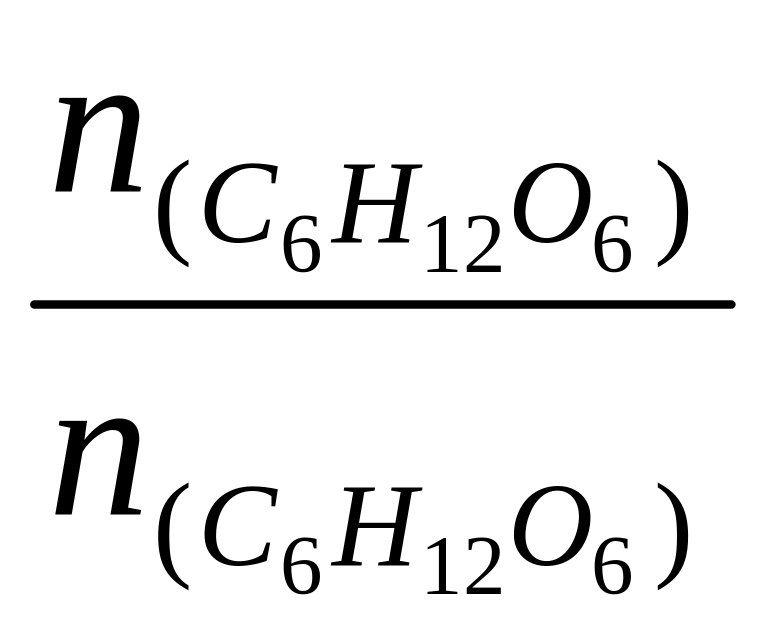 + n(H2O)
+ n(H2O)
n
(C6H12O6)
=
![]() = 0,2моль
= 0,2моль
M (H2O) = 1 ∙ 2 + 16 = 18г/моль
n(H2O)
=
![]() =
=
![]() = 3,56г/моль.
= 3,56г/моль.
N(C6H12O6)
=
![]() + 3,56 =
+ 3,56 =
![]() = 0,053.
= 0,053.
Відповідь: N(C6H12O6) = 0,053.
Завдання для самоперевірки та закріплення матеріалу
Скільки розчину з масовою часткою 10 % можна приготувати, виходячи з 75 г розчину з масовою часткою 25 % і води. Скільки см3 необхідно взяти для розчинення.
2. Визначити масову частку фосфорної кислоти у розчині, утвореному при розчиненні 20г фосфорної кислоти в 1дм3 води (1дм3 = 1000г)?
3. Один дм3 розчину (густина 1,31 г/см3) з масовою часткою азотної кислоти 0,5 розбавили 690 см3 води. Яка масова частка кислоти в утвореному розчині?
4. Яка масова частка нітрату калію в розчині, утвореному з 0,2 моль солі і 5 моль води?
5. Яка масова частка карбонату калію в розчині виготовленому з 0,2 моль солі і 172,4г води?
6. У якому випадку масова частка лугу у розчині буде більшою: при розчинені 30,6г оксиду барію у 369,4 см3 води чи 0,4 моль гідроксиду барію у 531,6 см3 води?
7. Визначити мольну частку сірчаної кислоти у водному розчині з масовою часткою 24%.
