
- •Міністерство освіти і науки, молоді та спорту україни
- •Одеської національної академії харчових технологій
- •Розглянуто:
- •2. Виконавець:
- •Рецензент:
- •Міністерство освіти і науки, молоді та спорту україни одеський технічний коледж одеської національної академії харчових технологій
- •Методичні вказівки до практичних робіт з предмету “Аналітична хімія” для студентів іі курсу
- •Практичне заняття № 1.
- •Стислі теоретичні відомості
- •Завдання для самоперевірки та закріплення матеріалу
- •Практичне заняття № 2.
- •Стислі теоретичні відомості
- •Завдання для самоперевірки та закріплення матеріалу
- •Практичне заняття № 3.
- •Стислі теоретичні відомості
- •Завдання для самоперевірки та закріплення матеріалу
- •Практичне заняття № 4.
- •Стислі теоретичні відомості.
- •Розрахункові формули у гравіметричному аналізі.
- •Завдання для самоперевірки та закріплення матеріалу
- •Практичне заняття № 5.
- •Стислі теоретичні відомості.
- •Завдання для самоперевірки та закріплення матеріалу
- •Практичне заняття № 6.
- •Стислі теоретичні відомості.
- •Завдання для самоперевірки та закріплення матеріалу
- •Практичне заняття № 7.
- •Стислі теоретичні відомості.
- •Завдання для самоперевірки та закріплення матеріалу
- •Практичне заняття № 8. Тема: Рішення задач в оксидиметрії.
- •Завдання для самоперевірки та закріплення матеріалу
- •Практичне заняття № 9.
- •Стислі теоретичні відомості.
- •Завдання для самоперевірки та закріплення матеріалу
- •Практичне заняття № 10.
- •Стислі теоретичні відомості.
- •Завдання для самоперевірки та закріплення матеріалу
- •Практичне заняття № 11.
- •Стислі теоретичні відомості.
- •Завдання для самоперевірки та закріплення матеріалу
- •Рекомендована література.
- •Додаток
- •Густина розчинів кон та NaOh
Завдання для самоперевірки та закріплення матеріалу
Скільки см3 соляної кислоти з густиною 1,057 г/см3 розчину з еквівалентною молярною концентрацією 0,1 мольекв/дм3?
Маємо розчин сірчаної кислоти з еквівалентною молярною концентрацією 0,05 мольекв/дм3. Визначити титр розчину сірчаної кислоти та титр розчину сірчаної кислоти по гідроксиду калію.
Для встановлення титру розчину сірчаної кислоти наважку 1,9452 г бури розчинили у мірній колбі на 100 см3. Визначте концентрацію бури (тетраборату натрію).
Наважка хлориду натрію 5,9120 г розчинили у мірній колбі на 1 л. Розчин довели до мітки. Чому дорівнює титр отриманого розчину по робочій речовині?
Практичне заняття № 6.
Тема: Розв’язування задач на визначення концентрації речовин.
Повинні знати: методику рішення задач, пов’язаних з переходом одного способу вираження концентрації в другий, змішування та розбавлення розчинів.
Повинні вміти: користуватися довідковими таблицями, визначати молярну, еквівалентну та моляльну концентрації.
Стислі теоретичні відомості.
Розчином називається гомогенна система змінного складу, що складається з двох або більшого числа компонентів, які подрібнені до розмірів атомів, іонів або молекул. Склад розчину кількісно прийнято виражати через безрозмірні відносні величини – частки (масову, об’ємну, молярну) і розмірні величини – концентрації.
Концентрацією розчину називається кількість розчиненої речовини, яка знаходиться в визначеній вагомій чи об’ємній кількості розчину чи розчинника.
Існує декілька засобів вираження концентрації розчинів.
Молярна концентрація – це відношення кількості розчиненої речовини до об’єму розчину.
См =
![]()
V, моль/дм3
V, моль/дм3
де m – маса розчиненої речовини, г;
М – молекулярна маса розчиненої речовини, моль/г;
V - об’єм розчину, дм3.
Приклад 1: Визначте масу нітрату натрію, яка потрібна для приготування 2 дм3 молярного розчину.
Дано: Розв’язання:
V = 2 дм3 Сm
=
= 2 дм3 Сm
=
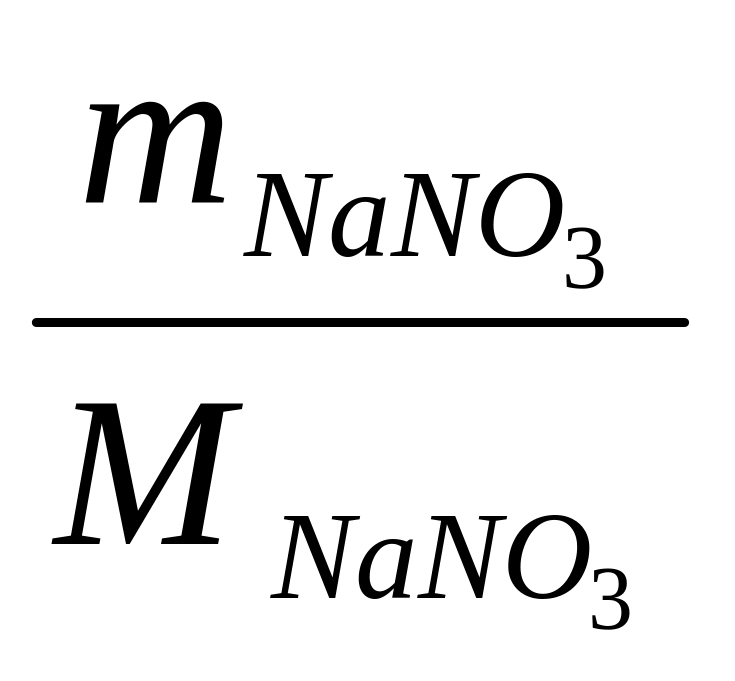 V
, моль/дм3
V
, моль/дм3
См = 0,1 моль/дм3 m (NaNО3) = Сm ∙ М(NaNО3) V
знаходимо М(NaNО3) = 85 г/моль, тоді
m (NaNО3) - ? m (NaNО3) = 0,1 8,5 2 = 17 г
Відповідь: m (NaNО3) = 17 г.
Еквівалентна концентрація – це відношення кількості речовини до об’єму розчину.
Секв =
![]() ,
моль∙екв/дм3
,
моль∙екв/дм3
де m – маса розчиненої речовини, г;
Е – еквівалент розчиненої речовини, г/моль;
V – об’єм розчину, дм3.
Якщо відома концентрація однієї з реагуючих речовин і об’єми розчинів обох речовин, що беруть участь у реакції, можна визначити еквівалентну концентрацію другого розчину.
![]()
Такі розрахунки проводять при визначенні концентрації речовин методом титрування.
Приклад 2: Який об’єм 0,12 еквівалентного розчину гідроксиду натрію потрібен для реакції з 40 см3 0,15 еквівалентного розчину сірчаної кислоти.
Дано: Розв’язання:
С екв
(NaОН) = 0,12 моль∙екв/дм3
екв
(NaОН) = 0,12 моль∙екв/дм3
![]() =
=
![]() , знаходимо:
, знаходимо:
V
(H2SO4)
= 40 cм3
V
(NaОH) =
![]() ,
см3
,
см3
Секв
(H2SO4)
= 0,12
моль∙екв/дм3
V (NaОH)
=
![]() =
50 см3
=
50 см3
 V
(NaОH) - ?
V
(NaОH) - ?
3. Моляльна концентрація – відношення кількості розчиненої речовини до маси розчинника.
См
=
![]() ,
моль/кг
,
моль/кг
де n – кількість молів розчиненої речовини.
L – маса розчинника, кг
так як n = , то
См
=
![]() ,
моль/кг.
,
моль/кг.
де m – маса розчинної речовини, г
М – молекулярна маса розчиненої речовини, г/моль
L – маса розчинника, кг.
Моляльність розчину, на відмінність від його молекулярності, не змінюється при змінені температури.
Приклад 3: Визначити молекулярну, еквівалентну і молярну концентрації розчину CuSO4 з масовою часткою CuSO4 10% (ρ = 1,107г/см3).
Дано: Рішення:
W (CuSO4)
= 10% 1. Знайдемо вихідні формули:
(CuSO4)
= 10% 1. Знайдемо вихідні формули:
ρ
= 1,107 г/см3
См
=
![]() ,
моль/кг
,
моль/кг
См - ? Секв = , моль∙екв/см3
Сeкв - ? Сm = , моль/см3
Сm - ?
2. Знайдемо молярну та еквівалентну масу розчинної речовини:
M(CuSO4) = 64 + 32 + 16 ∙ 4 = 160 г/моль.
Е(CuSO4)
=
![]() =
=
![]() = 80 г/моль.
= 80 г/моль.
3. Знайдемо масу 1 дм3 розчину:
m = V ∙ ρ = 1000 ∙ 1,107 = 1107г.
4. Визначимо скільки грамів CuSO4 міститься в 1дм3 розчину, тобто в 1107г.
W
=
![]() ∙ 100%
∙ 100%
Mречовини
=
![]() =
=
![]() =
110,7 г.
=
110,7 г.
m(CuSO4) = 110,7г.
5. Знаходимо молярну концентрацію розчину:
См
=
![]() = 0,69 моль/дм3
= 0,69 моль/дм3
6. Знаходимо еквівалентну концентрацію розчину:
Сeкв
=
![]() = 1,38 моль∙екв./дм3.
= 1,38 моль∙екв./дм3.
7. Для визначення моляльної концентрації згадаємо, що моляльність показує число молів розчиненої речовини, яка міститься в 1 кг., (1000г) розчинника:
Сm
=
![]() ,
моль/кг
,
моль/кг
де mреч. – маса розчиненої речовини, г
L – маса розчинника, г
М – молярна маса розчиненої речовини, г/моль
В 100г розчину з масовою часткою 10% міститься 10г CuSO4 та 90г води.
Cm
=
![]() = 0,646 моль/кг.
= 0,646 моль/кг.
Відповідь: См = 0,69 моль/дм3, Ceкв = 1,38 моль∙екв/дм3, Сm = 0,64 моль/кг.
