
- •Міністерство освіти і науки, молоді та спорту україни
- •Одеської національної академії харчових технологій
- •Розглянуто:
- •2. Виконавець:
- •Рецензент:
- •Міністерство освіти і науки, молоді та спорту україни одеський технічний коледж одеської національної академії харчових технологій
- •Методичні вказівки до практичних робіт з предмету “Аналітична хімія” для студентів іі курсу
- •Практичне заняття № 1.
- •Стислі теоретичні відомості
- •Завдання для самоперевірки та закріплення матеріалу
- •Практичне заняття № 2.
- •Стислі теоретичні відомості
- •Завдання для самоперевірки та закріплення матеріалу
- •Практичне заняття № 3.
- •Стислі теоретичні відомості
- •Завдання для самоперевірки та закріплення матеріалу
- •Практичне заняття № 4.
- •Стислі теоретичні відомості.
- •Розрахункові формули у гравіметричному аналізі.
- •Завдання для самоперевірки та закріплення матеріалу
- •Практичне заняття № 5.
- •Стислі теоретичні відомості.
- •Завдання для самоперевірки та закріплення матеріалу
- •Практичне заняття № 6.
- •Стислі теоретичні відомості.
- •Завдання для самоперевірки та закріплення матеріалу
- •Практичне заняття № 7.
- •Стислі теоретичні відомості.
- •Завдання для самоперевірки та закріплення матеріалу
- •Практичне заняття № 8. Тема: Рішення задач в оксидиметрії.
- •Завдання для самоперевірки та закріплення матеріалу
- •Практичне заняття № 9.
- •Стислі теоретичні відомості.
- •Завдання для самоперевірки та закріплення матеріалу
- •Практичне заняття № 10.
- •Стислі теоретичні відомості.
- •Завдання для самоперевірки та закріплення матеріалу
- •Практичне заняття № 11.
- •Стислі теоретичні відомості.
- •Завдання для самоперевірки та закріплення матеріалу
- •Рекомендована література.
- •Додаток
- •Густина розчинів кон та NaOh
Завдання для самоперевірки та закріплення матеріалу
1. Яку хімічну формулу має речовина, яка в своєму складі має 62,53% Са та 37,47% С?
2. Пиролюзід має склад 63,19% Mn; 36,81% О. Якій хімічній формулі відповідає його склад?
3. До складу речовини входить 36,23% МgО та 63,77% Р2О5. Якою хімічною формулою виражається його склад?
Практичне заняття № 4.
Тема: Розрахунки у гравіметричному методі аналізу.
Повинні знати: методику розрахунків по трьох типах вагових визначень.
Повинні вміти: визначати вологість, зольність, відсотковий склад речовин, фактор перерахунку.
Стислі теоретичні відомості.
Мірою кількості речовини у гравіметричному аналізі є наважка. Тому слід уміти правильно її розраховувати при визначенні вологості сировини або готового виробу, % кристалічної води у кристалогідраті мідного купоросу або хлориду барію при визначенні складової частини речовини шляхом переведення її в важкорозчинні сполуку у вигляді кристалічного або аморфного осаду.
Необхідно пам’ятати оптимальну масу аморфного осаду та кристалічного, тільки після цього можна буде провести необхідні розрахунки. Для аморфного осаду оптимальна маса 0,1 – 0,3г, а для кристалічного 0,4 – 0,6г.
У гравіметричному методі використовуються три типи вагових визначень:
Визначення вилучаємої складової частини аналізуємої речовини (вологості). Розрахунок розміру наважки ведеться виходячи з очікуємого % вологості.
Визначення видаленої складової частини аналізуємої речовини (зольності). Розрахунок розміру наважки ведеться виходячи з очікуємого % золи.
Визначення складової частини аналізуємої речовини шляхом переведення її в осад. Розрахунок розміру наважки ведеться виходячи з оптимальної маси отриманого осаду.
Розрахункові формули у гравіметричному аналізі.
1. Визначення вологості:
![]() , %
, %
де
![]() -
кількість видаленої вологи, г
-
кількість видаленої вологи, г
![]() -
наважка, г.
-
наважка, г.
2.
Визначення зольності: Х(Н) =
![]() , %
, %
де
![]() -
маса золи, г
-
маса золи, г
- наважка, г.
3.Визначення %-ного складу речовини:
%А =
![]()
де - маса осаду, г
- наважка, г
F – фактор перерахунку (показує кількість визначаємої речовини в 1г осаду)
![]()
де А – атомна маса
М – молекулярна маса.
Приклад 1. Визначити наважку мідного купоросу, необхідний для визначення кристалічної води.
Рішення.
CuSO4 5Н2О містить 5Н2О
100 г містить х
М = 250 г/моль
5М = 5 18 = 90 г/моль
х =
![]()
Наважка мідного купоросу визначається по принципу: на кожний % кристалічної води береться 0,1г наважки, отже на 36% кристалічної води береться 3,6г.
Приклад 2. Визначити фактор перерахунку Са в СаО.
Рішення.
Фактор перерахунку (аналітична множина) визначається за формулою
![]()
![]()
Приклад 3. Визначити склад барію в двухводному хлориді барію, якщо маса осаду сульфату барію дорівнює 0,5505г з 0,9213г хлориду барію.
 Дано:
Рішення.
Дано:
Рішення.
![]() = 0,9213 г. 1. Відсотковий склад барію
визначається по формулі
= 0,9213 г. 1. Відсотковий склад барію
визначається по формулі

![]() = 0,5505 г % Ва =
= 0,5505 г % Ва =
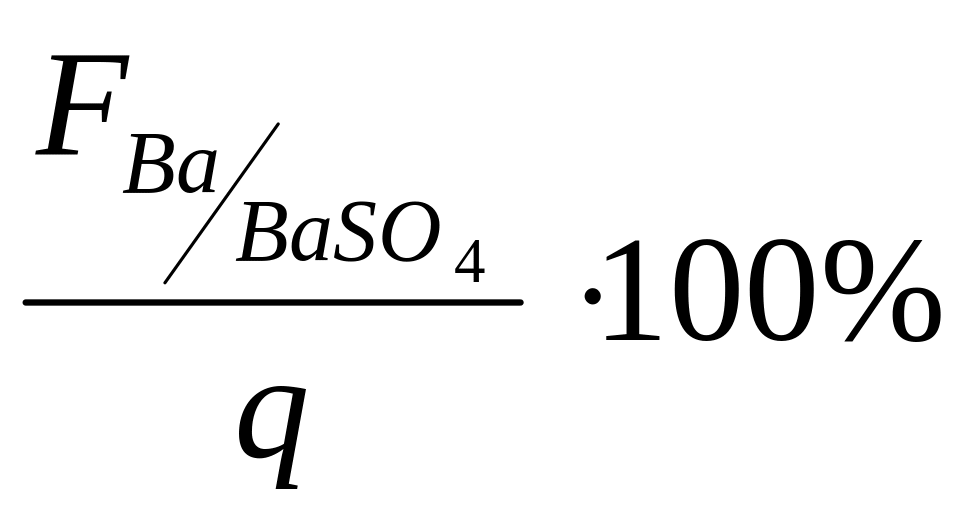
% Ва - ?
2. Визначаємо фактор перерахунку
![]()
![]()
3.Підставивши значення у формулу визначаємо %-ий склад барію
%
Ва =
![]()
