
- •10. Связь периодич-го з. Со строением эл-ных оболочек атомов. Пр. Клечковского. Энергетич. Ячейки. Правило Хунда.
- •8. Волновые свойства электрона. Квантовые числа,s-, p-,d-,f-состояния электронов. Электронные орбитали.
- •9. Принцип Паули. Емкость энергетических уровней и подуровней атомов элементов.
- •16.Ионная (электронная связь).
- •15.Направленность ковалентной связи ᵹ- и π-связи. Гибридизация атомных орбиталей.
- •19.Донорно-акцепторный механизм ков.Св.. Комплексные соединения.
- •17. Представление о методе молекулярных орбиталей.
- •14. Ков.(атомная) св.. Метод валентных связей. Возбужденные состояния атомов. Валентность.
- •13.Образование химической связи. Энергия и длина связи.
- •11. Периодич.З.Д.И.Менделеева и периодич.Сист. Эл-ов: ряды, периоды, группы, подгруппы, порядковый номер эл-та.
- •7. З.Хим.Экв-ов. Молярные экв-ные массы сложных в-в.
- •3. Понятие о химическом эквиваленте и эквивалентной массе простых и сложных веществ. Закон химических эквивалентов.
- •6. Основные стехиометрические законы.
- •5. Основные газовые законы. Определение молекулярных масс газообразных веществ.
- •21. Система. Фаза. Компонент. Параметры. Функции состояния: внутренняя энергия и энтальпия. Стандартные условия.
- •22. Первое начало термодинамики. Закон Гесса как следствие первого начала термодинамики. Термохимические расчеты.
- •27. Объединенная формула первого и второго начала термодинамики. Свободная энергия Гиббса и Гельмгольца.Первый закон.
- •29.Условия самопроизвольного протекания химических реакций.
- •34.Скорость химической реакции. Закон действующих масс. Константа скорости.
- •36. .Кинетическая классификация по степени сложности. Обратимые и необратимые реакции.
- •41. Дисперсные системы. Коллоидные растворы.
- •37 .Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса
- •44. Растворимость газов в жидкостях. Закон Генри-Дальтона. Закон распределения.
- •50.Произведение растворимости.
- •12. Периодическое изменение свойств химических элементов. Радиус атомов, сродство электрону,
- •57.Электролиз. Последовательность разряда ионов на катоде и аноде.
- •3) Ме,стоящие в ряду напр-я посла водорода
- •59.Классификация химических источников тока.
- •60. Коррозия металлов. Химическая и электрохимическая коррозия.
- •61. Основные методы борьбы с коррозией.
- •62. Кристаллическое состояние вещества. Химическая связь в кристаллах.
- •64.Сущн-ть физико-химич.Анализа.Пр-ло фаз.Диаграмма состояния воды.
- •67.Адсорбция и абсорбция.
- •64. Основные принципы построения диаграммы плавкости бинарных систем.
- •1. Принцип непрерывности.
- •2. Принцип соответствия.
- •65. Эвтектическая диаграмма плавкости (без образования твердых растворов).
37 .Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса
.Согласно
правилу
Вант-Гоффа,
повышение темп-ры на каждые 100
увеличивает ск-ть реакции в 2-4 раза.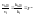 темп-ный
коэфф-т ск-ти р-и.
темп-ный
коэфф-т ск-ти р-и.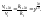 Пример.
Пример.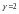 и
и
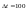 тогда
тогда
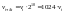 С ростом темп-ры
С ростом темп-ры
происходит
перераспределение эн.м/у мол-лами так,
что резко возрастает число акт-х молекул,
обладающих некоторым избытком эн-и (эн.
активации). Большая часть поступающей
в систему энергии тратится на ослабление
внутримолекулярных связей, что и делает
молекулы активными.С.
Аррениус
установил опытным путем зависимость:
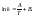 к – константа скорости, А и В –
индивидуальные постоянные, характерные
для данной реакции.
к – константа скорости, А и В –
индивидуальные постоянные, характерные
для данной реакции.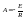 .Физич.смысл
эн.активации. Рассмотрим
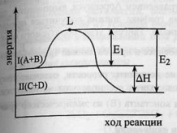
график изменения эн. в процессе протекания
экзотермической реакции. Уровень L
отвечает наименьшему запасу энергии у
молекул, которые необходим для их
результативного столковения.Разность
L
и I
– энергия активации прямой реакции, L
и II
– обратной.По пути из исходного состояния
в конечное система должна пройти через
некоторый энергетический барьер. И
только акт-е молекулы могут его преодолеть.
Рассмотрим график изменения эн-и в
процессе протекания эндотерм-й
реакции..Проведем
небольшие преобразования:
.Физич.смысл
эн.активации. Рассмотрим
график изменения эн. в процессе протекания
экзотермической реакции. Уровень L
отвечает наименьшему запасу энергии у
молекул, которые необходим для их
результативного столковения.Разность
L
и I
– энергия активации прямой реакции, L
и II
– обратной.По пути из исходного состояния
в конечное система должна пройти через
некоторый энергетический барьер. И
только акт-е молекулы могут его преодолеть.
Рассмотрим график изменения эн-и в
процессе протекания эндотерм-й
реакции..Проведем
небольшие преобразования: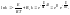
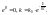
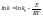 - эмпирическое
ур-е Аррениуса.
- эмпирическое
ур-е Аррениуса.

38.Энергия
активации химической реакции. Аналитический
и графический метод расчета.С
ростом температуры происходит
перераспределение энергии между
молекулами так, что резко возрастает
число активных молекул, облаающих
некоторым избытком энергии (энергией
активации). Большая часть поступающей
в систему энергии тратится на ослабление
внутримолекулярных связей, что и делает
молекулы активными.С.
Аррениус
установил опытным путем зависимость:
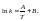 где к – константа скорости, А и В –
индивидуальные постоянные, характерные
для данной реакции.
где к – константа скорости, А и В –
индивидуальные постоянные, характерные
для данной реакции.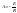 (энергия активации, постоянная –
8,31).Графический
расчет энергии активации.По
опытным данным строят график зависимости
(энергия активации, постоянная –
8,31).Графический
расчет энергии активации.По
опытным данным строят график зависимости
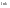 от обратной температуры. Если закон
выполняется, на графике должна получиться
прямая линия. Тангенс угла, образуемого
Ох и прямой,
от обратной температуры. Если закон
выполняется, на графике должна получиться
прямая линия. Тангенс угла, образуемого
Ох и прямой,
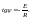 Аналитический
расчет энергии активации.Полагая,
что в небольшом интервале
Аналитический
расчет энергии активации.Полагая,
что в небольшом интервале
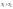 энергия постоянна, можно написать:
энергия постоянна, можно написать:
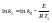
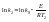
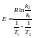 Энергия
активации зависит от температуры.Чем
меньше энергия, тем легче идет реакция
и тем больше скорость реакции при данной
температуре.Реакции с энергией меньше
Энергия
активации зависит от температуры.Чем
меньше энергия, тем легче идет реакция
и тем больше скорость реакции при данной
температуре.Реакции с энергией меньше
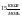 протекают практически мгновенно.
протекают практически мгновенно.
39. Ск-ть гетерогенной хим.реакции. Особенности ее протекания.
Гетерогенные
(многофазные) реакции происходят на
поверх-ти раздела соприкасающихся фаз.
относятся: горение топлива, окисление
металлов кислородом, растворение газа
в жидкостях.Ск-ть реакций зависит от
размеров и состояния поверхности раздела
фаз. Гетерогенные процессы многостадийны.
Кроме осн-го процесса,обязательны стадии
подвода к этой поверх-ти исходных веществ
и отвода от нее продуктов реакции.Если
определяющей стадией является хим.реакция
на поверхности раздела фаз, то процесс
описывается законами хим.кинетики
Если, как это обычно бывает, наиболее
медленно совершается подвод и отвод,
то процесс описывается законами диффузии
. Повышение темп-ры на каждые 100
увеличивает коэффициент диффузии на
20%, тогда как скорость реакции увеличивается
в 2-4 раза.Диффузия оказывает большое
влияние на протекание гетерогенных
процессов.1й
закон диффузии.Масса
веществ
 переносимого путем диффузии в направлении
х через перпендикулярную этому направлению
площадку, пропорциональна коэффициенту
диффузии D,
площади S,
времени
переносимого путем диффузии в направлении
х через перпендикулярную этому направлению
площадку, пропорциональна коэффициенту
диффузии D,
площади S,
времени
 и градиенту концентрации
и градиенту концентрации
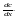
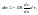 Ск-ть
диффузии
Ск-ть
диффузии
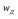
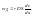 Знак
«-» указывает, что процесс диффузии
направлен в сторону понижения
концентрации.
Знак
«-» указывает, что процесс диффузии
направлен в сторону понижения
концентрации.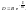 Е – энергия активации.2й
закон диффузии выражает
зависимость изменения концентрации в
объеме одной из соприкасающихся фаз от
времени:
Е – энергия активации.2й
закон диффузии выражает
зависимость изменения концентрации в
объеме одной из соприкасающихся фаз от
времени:
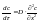 Стационарная
диффузия.При
СД концентрация меняется
только
с расстоянием (х), от времени – нет.
Стационарная
диффузия.При
СД концентрация меняется
только
с расстоянием (х), от времени – нет.
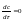 =>
=>
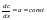
 а – градиент концентрации.Эффективный
путь диффузии.при
а – градиент концентрации.Эффективный
путь диффузии.при


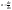
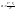
 толщина диффузионного слоя.Ур-е
стационарной диффузии.
толщина диффузионного слоя.Ур-е
стационарной диффузии.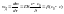
 коэффициент массопередачи
коэффициент массопередачи
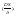 Ск-ть
растворения тв.тела в жидкостях.Поверхность
тв. тела – S,
концентрация насыщенного раствора
-
Ск-ть
растворения тв.тела в жидкостях.Поверхность
тв. тела – S,
концентрация насыщенного раствора
- конц-я
в объеме раствора -
конц-я
в объеме раствора -
 толщина
диффузионного слоя -
толщина
диффузионного слоя -
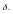 Ск-ть
растворения значительно больше ск-ти
диффузионного переноса вещества в объем
раствора.Кол-во вещества, растворяющегося
в единицу времени, - L.Фактически
ск-ть процесса
Ск-ть
растворения значительно больше ск-ти
диффузионного переноса вещества в объем
раствора.Кол-во вещества, растворяющегося
в единицу времени, - L.Фактически
ск-ть процесса
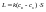 k
– константа скорости,
k
– константа скорости,
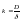
Ур-е
стационарной диффузии:
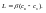
42
.Растворы
(разбавленные, концентрированные,
насыщенные, перенасыщенные). Растворимость.
Способы выражения концентрации
растворов.Раствор
- гомогенная система, в которой одно
вещество равномерно распределено в
среде другого.
Р-р
- гомогенная система. В р-ре различают
растворитель
и растворяемое
вещество.Р-ры
газа в газе или жидкости в жидкости
называют смесями.
Разб.р-р–р-р,
в котором содержание одного из компонентов
меньше содержания другого компонента.Конц.
р-р
– р-р, в котором отн-е кол-ва растворенного
вещ-ва и растворителя одного порядка.
Насыщ.р-р-растворенное
вещ-во при данных условиях более не
растворяется, даже при продолжительном
перемешивании. Концентрация
насыщ-го раст-ра - мера растворимости
вещ-ва при данных условиях. Раствор
пересыщенный,
если содержание растворенного вещ-ва
превышает предел насыщения данного
раствора.Пример.
При
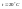 можно приготовить 20%-ный раствор
можно приготовить 20%-ный раствор
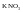 .
Концентрация
раст-ра
– кол-ное выражение его состава.Молярные
доли
(дроби) показывают какую долю составляет
число молей данного компонента от общего
числа молей всех компонентов.Пример.
Компоненты А и В. Массы компонентов
.
Концентрация
раст-ра
– кол-ное выражение его состава.Молярные
доли
(дроби) показывают какую долю составляет
число молей данного компонента от общего
числа молей всех компонентов.Пример.
Компоненты А и В. Массы компонентов
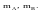 Число молей компонентов -
Число молей компонентов -
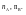 Молярная
доля
компонента А
Молярная
доля
компонента А
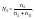
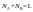 2.
Процентное
выражение концентрации
2.
Процентное
выражение концентрации
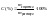 Концентрация,
выражаемая через плотность
раствора.Вычисляется
с помощью приборов и специальных таблиц
значений.4. Молярная
концентрация
Концентрация,
выражаемая через плотность
раствора.Вычисляется
с помощью приборов и специальных таблиц
значений.4. Молярная
концентрация
 кол-во
молей раств-го вещ-ва в 1ом литре
раст-ра.
кол-во
молей раств-го вещ-ва в 1ом литре
раст-ра.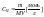 .Моляльная
концентация
.Моляльная
концентация
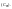 кол-во
молей раств-го вещ-ва приходится на 1000
грамм раств-ля
кол-во
молей раств-го вещ-ва приходится на 1000
грамм раств-ля Нормальная
концентрация
Нормальная
концентрация
 кол-во
грамм-эквивалентов раств-го вещ-ва
содержится в литре раст-ра
кол-во
грамм-эквивалентов раств-го вещ-ва
содержится в литре раст-ра
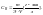 Титр
– число гр раств-го вещ-ва в 1 мл
раствора.Пример.
Титр
– число гр раств-го вещ-ва в 1 мл
раствора.Пример.
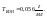
43.
Физические и химические процессы при
растворении. Растворимость твердых тел
и жидкостей в жидкостях.Р-рам
присущи признаки как химич.(однородность
раствора) соединения, так и механической
(изменение состава р-ра в широких
пределах, а также возможность обнаружения
в св-вах р-ра свойтсв отдельных слагающих
его компонентов) смеси. Физич.теория
растворов (Вант-Гофф).Растворитель
я-ся индифферентной средой, в которой
равномерно размешаны молекулы
растворенного в-ва по всему объему р-ра.
Взаимодействия между чатицами и
молекулами нет. Теория оправдывается
для разбавленных р-ров неэлектролитов.
Химич.теория
р-ров (Менделеев).Р-ль
дает с растворенным в-вом определенные
соединения – сольваты.Молекулы
сольватов образуют с растворителем
молекулярную смесь.Причина
образования сольватов – проявление
донорно-акцепторных и водородных связей.
Вокруг ионов располагаются молекулы
растворителя, образуя сольватные
слои
(оболочки).Сольваты менее прочны, чем
обычные химические соединения. Легко
разрушаются даже при небольшом повышении
температуры растворов.Растворение
сопровождается выделением/поглощением
теплоты, сокращением/увеличением
объема.Теплота
растворения вещества
– кол-во теплоты, поглощаемой (выделяемой)
при растворении одного моля
вещества.Растворимость
твердых веществ в жидкостях.Зависит
от природы тв.тел, природы растворителя
и температуры.С повышением температуры,
как правило, растворимость увеличивается
(так как теплоты растворения имеют
отрицат. значения).Для идеальных р-ров
справедливо уравнение Шредера:
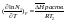 N1
– растворимость тв.вещ-ва,
N1
– растворимость тв.вещ-ва,
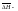 энтальпия растворения 1 моля вещ-ва в
насыщенном растворе. Растворение
твердого вещества можно представить в
две стадии: плавление вещества и смешение
жидкого вещества с раствором. Тогда
энтальпия смешения равна нулю,
энтальпия растворения 1 моля вещ-ва в
насыщенном растворе. Растворение
твердого вещества можно представить в
две стадии: плавление вещества и смешение
жидкого вещества с раствором. Тогда
энтальпия смешения равна нулю,
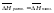 Идеальная
растворимость
увелич-ся с повышением темп-ры. При
понижении температуры происходит
выпадение вещества в осадок – процесс
кристаллизации.
Растворимость жидкостей в
жидкостях.Растворимость
увеличивается с повышением темп-ры и
почти не зависит от давления.Сущ.
неограниченная
растворимость и растворимость до
известного предела.1.
жидкости смешиваются в любых пропорциях
(спирт и вода).2. имеет место расслаивание
(образование двух слоев – верхний и
нижний). пример: эфир и вода.Расслаивание
умень-ся с ростом темп-ры и исчезает при
некоторой (критической) темп-ре.
Идеальная
растворимость
увелич-ся с повышением темп-ры. При
понижении температуры происходит
выпадение вещества в осадок – процесс
кристаллизации.
Растворимость жидкостей в
жидкостях.Растворимость
увеличивается с повышением темп-ры и
почти не зависит от давления.Сущ.
неограниченная
растворимость и растворимость до
известного предела.1.
жидкости смешиваются в любых пропорциях
(спирт и вода).2. имеет место расслаивание
(образование двух слоев – верхний и
нижний). пример: эфир и вода.Расслаивание
умень-ся с ростом темп-ры и исчезает при
некоторой (критической) темп-ре.
