
- •10. Связь периодич-го з. Со строением эл-ных оболочек атомов. Пр. Клечковского. Энергетич. Ячейки. Правило Хунда.
- •8. Волновые свойства электрона. Квантовые числа,s-, p-,d-,f-состояния электронов. Электронные орбитали.
- •9. Принцип Паули. Емкость энергетических уровней и подуровней атомов элементов.
- •16.Ионная (электронная связь).
- •15.Направленность ковалентной связи ᵹ- и π-связи. Гибридизация атомных орбиталей.
- •19.Донорно-акцепторный механизм ков.Св.. Комплексные соединения.
- •17. Представление о методе молекулярных орбиталей.
- •14. Ков.(атомная) св.. Метод валентных связей. Возбужденные состояния атомов. Валентность.
- •13.Образование химической связи. Энергия и длина связи.
- •11. Периодич.З.Д.И.Менделеева и периодич.Сист. Эл-ов: ряды, периоды, группы, подгруппы, порядковый номер эл-та.
- •7. З.Хим.Экв-ов. Молярные экв-ные массы сложных в-в.
- •3. Понятие о химическом эквиваленте и эквивалентной массе простых и сложных веществ. Закон химических эквивалентов.
- •6. Основные стехиометрические законы.
- •5. Основные газовые законы. Определение молекулярных масс газообразных веществ.
- •21. Система. Фаза. Компонент. Параметры. Функции состояния: внутренняя энергия и энтальпия. Стандартные условия.
- •22. Первое начало термодинамики. Закон Гесса как следствие первого начала термодинамики. Термохимические расчеты.
- •27. Объединенная формула первого и второго начала термодинамики. Свободная энергия Гиббса и Гельмгольца.Первый закон.
- •29.Условия самопроизвольного протекания химических реакций.
- •34.Скорость химической реакции. Закон действующих масс. Константа скорости.
- •36. .Кинетическая классификация по степени сложности. Обратимые и необратимые реакции.
- •41. Дисперсные системы. Коллоидные растворы.
- •37 .Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса
- •44. Растворимость газов в жидкостях. Закон Генри-Дальтона. Закон распределения.
- •50.Произведение растворимости.
- •12. Периодическое изменение свойств химических элементов. Радиус атомов, сродство электрону,
- •57.Электролиз. Последовательность разряда ионов на катоде и аноде.
- •3) Ме,стоящие в ряду напр-я посла водорода
- •59.Классификация химических источников тока.
- •60. Коррозия металлов. Химическая и электрохимическая коррозия.
- •61. Основные методы борьбы с коррозией.
- •62. Кристаллическое состояние вещества. Химическая связь в кристаллах.
- •64.Сущн-ть физико-химич.Анализа.Пр-ло фаз.Диаграмма состояния воды.
- •67.Адсорбция и абсорбция.
- •64. Основные принципы построения диаграммы плавкости бинарных систем.
- •1. Принцип непрерывности.
- •2. Принцип соответствия.
- •65. Эвтектическая диаграмма плавкости (без образования твердых растворов).
34.Скорость химической реакции. Закон действующих масс. Константа скорости.
Скорость
гомогенной
(однофазной) реакции зависит от природы
реагирующих веществ, их концентрации
и температуры.Скорость гетерогенных
(многофазных) процессов зависят от
размеров и состояния поверхности раздела
фаз.Примечание.
Гетерогенные – процессы, происходящие
на поверхности раздела соприкасающихся
фаз. (горение топлива, окисление металлом
кислородом воздуха).Закон
действующих масс.Справедлив
для гомогенных реакций.Формулировка:
при
постоянной температуре скорость
химической реакции пропорциональна
произведению концентраций реагирующих
веществ.Константа скорости обозначается
как
 Пример.
Пример.

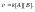 в
квадратных скобках концентрации
веществ.
в
квадратных скобках концентрации
веществ.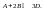
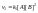
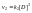 «к»
не зависит от концентрации в каждый
момент времени.
«к»
не зависит от концентрации в каждый
момент времени.
35.
Молекулярность и порядок реакции.Реакции
с точки зрения частиц классифицируются
по признаку молекулярности
или по признаку порядка
последних.Молекулярность определяется
по числу молекул, одновременное соударение
которых приводит к химическому
воздействию.Одномолекулярная
реакция.

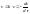 с – концентрация исходного вещества.
Двухмолекулярная
реакция.
с – концентрация исходного вещества.
Двухмолекулярная
реакция.
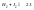
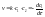
Трехмолекулярная
реакция.
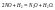

Порядок
реакции =сумме показателей степеней у
концентраций в уравнении, выражающем
зависимость скорости реакции от
концентраций реагирующих веществ.Реакция
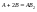 формально 3хмолекулярна, но фактически
яв-ся 2хмолекулярной, так как реакция
протекает в 2 стадии:
формально 3хмолекулярна, но фактически
яв-ся 2хмолекулярной, так как реакция
протекает в 2 стадии: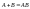
36. .Кинетическая классификация по степени сложности. Обратимые и необратимые реакции.
По
степени сложности реакции подразделяются
на изолированные, параллельные,
сопряженные, последовательные
(многоступенчатые), обратимые и
необратимые.Изолированные
– при их протекании образуются продукты
только одного типа.Параллельные
– в ходе них взятые вещества одновременно
реагируют в двух или более направлениях
(образуются разные продукты).Пример.
Разложение бертолетовой соли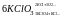 Скорость
реакции:
Скорость
реакции:
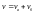 Сопряженные
– совместные реакции типа:
Сопряженные
– совместные реакции типа:
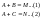 Вторая
реакция протекает лишь совместно с
первой.А – актор реакции, B
– индуктор реакции, С –
акцептор.Последовательные.
Вторая
реакция протекает лишь совместно с
первой.А – актор реакции, B
– индуктор реакции, С –
акцептор.Последовательные.
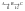 В
– промежуточный продукт.Обратимые и
необратимые. Подавляющее большинство
химических реакций являются обратимыми,
т.е. могут протекать в двух направлениях.
Скорость реакции:
В
– промежуточный продукт.Обратимые и
необратимые. Подавляющее большинство
химических реакций являются обратимыми,
т.е. могут протекать в двух направлениях.
Скорость реакции:
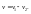 Различают
практически
необратимые
и совершенно
необратимые
реакции.Практически необратимые –
реакции, в результате которых образуется
осадок.Совершенно необратимые –
протекают только в одном направлении.
Пример.
Различают
практически
необратимые
и совершенно
необратимые
реакции.Практически необратимые –
реакции, в результате которых образуется
осадок.Совершенно необратимые –
протекают только в одном направлении.
Пример.
 Более
подробно рассмотрим обратимую реакцию:
Более
подробно рассмотрим обратимую реакцию:
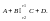
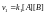
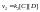

41. Дисперсные системы. Коллоидные растворы.
Д.с.Это система из двух и более в-в,которые практически не смешиваются и не реагируют друг с другом. Состоят из двух и более фаз(тел)с сильно развитой поверхностью раздела.в грубодисперсных системах частицы имеют размер от 10-4и выше,в коллоидных системах от 10-7 до 10-5-10-4. Дисп.сист.: эмульсии(масло в воде), сустензии(глина в воде),коллоидные растворы.
Коллоидные растворы -высокодисперсные системы частицы интенсивно участвуют в броуновском движении,заполняя вечь объем дисперсной системы. Коллоидные частицы способны рассеивать свет.
