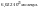- •10. Связь периодич-го з. Со строением эл-ных оболочек атомов. Пр. Клечковского. Энергетич. Ячейки. Правило Хунда.
- •8. Волновые свойства электрона. Квантовые числа,s-, p-,d-,f-состояния электронов. Электронные орбитали.
- •9. Принцип Паули. Емкость энергетических уровней и подуровней атомов элементов.
- •16.Ионная (электронная связь).
- •15.Направленность ковалентной связи ᵹ- и π-связи. Гибридизация атомных орбиталей.
- •19.Донорно-акцепторный механизм ков.Св.. Комплексные соединения.
- •17. Представление о методе молекулярных орбиталей.
- •14. Ков.(атомная) св.. Метод валентных связей. Возбужденные состояния атомов. Валентность.
- •13.Образование химической связи. Энергия и длина связи.
- •11. Периодич.З.Д.И.Менделеева и периодич.Сист. Эл-ов: ряды, периоды, группы, подгруппы, порядковый номер эл-та.
- •7. З.Хим.Экв-ов. Молярные экв-ные массы сложных в-в.
- •3. Понятие о химическом эквиваленте и эквивалентной массе простых и сложных веществ. Закон химических эквивалентов.
- •6. Основные стехиометрические законы.
- •5. Основные газовые законы. Определение молекулярных масс газообразных веществ.
- •21. Система. Фаза. Компонент. Параметры. Функции состояния: внутренняя энергия и энтальпия. Стандартные условия.
- •22. Первое начало термодинамики. Закон Гесса как следствие первого начала термодинамики. Термохимические расчеты.
- •27. Объединенная формула первого и второго начала термодинамики. Свободная энергия Гиббса и Гельмгольца.Первый закон.
- •29.Условия самопроизвольного протекания химических реакций.
- •34.Скорость химической реакции. Закон действующих масс. Константа скорости.
- •36. .Кинетическая классификация по степени сложности. Обратимые и необратимые реакции.
- •41. Дисперсные системы. Коллоидные растворы.
- •37 .Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса
- •44. Растворимость газов в жидкостях. Закон Генри-Дальтона. Закон распределения.
- •50.Произведение растворимости.
- •12. Периодическое изменение свойств химических элементов. Радиус атомов, сродство электрону,
- •57.Электролиз. Последовательность разряда ионов на катоде и аноде.
- •3) Ме,стоящие в ряду напр-я посла водорода
- •59.Классификация химических источников тока.
- •60. Коррозия металлов. Химическая и электрохимическая коррозия.
- •61. Основные методы борьбы с коррозией.
- •62. Кристаллическое состояние вещества. Химическая связь в кристаллах.
- •64.Сущн-ть физико-химич.Анализа.Пр-ло фаз.Диаграмма состояния воды.
- •67.Адсорбция и абсорбция.
- •64. Основные принципы построения диаграммы плавкости бинарных систем.
- •1. Принцип непрерывности.
- •2. Принцип соответствия.
- •65. Эвтектическая диаграмма плавкости (без образования твердых растворов).
11. Периодич.З.Д.И.Менделеева и периодич.Сист. Эл-ов: ряды, периоды, группы, подгруппы, порядковый номер эл-та.
в 1869 сформулировав его: «Св-ва простых тел, а также формы и св-ва соед.эл-ов находятся в периодич.зависимости от величины атомных весов эл-ов.» В 1869 было известно всего 63 элемента, в настоящее время – 109.
Периодич.сист.– по сути изобр.периодич.з..
В наст.вр.предложено несколько вариантов сист.,но мы рассмотрим более традиционную, предложенную Менделеевым.Она имеет 3 малых периода (1-3) и 4 больших (4-7).
Период – последовательность атомов с одинаковым числом эл-ных слоев.Большие периоды содержать 2 ряда (четный и нечетный). Периоды нач-ся с активн.ме,по мере продвиж. ус-ся неметалл.св-ва, а завершаются галогеном и инертным газом.Эл-ты, которые осущ. переход от ме к неме,наз-ся переходными. Эл-ты группы проявляют одинаковую макс.валентность по кислороду, равную номеру группы.Элементы гл.подгрупп проявляют опр.валентность по водороду. В главных подгруппах по мере движ.вниз металл.св-ва усиливаются, побочных – ослабевают.
7. З.Хим.Экв-ов. Молярные экв-ные массы сложных в-в.
3. Понятие о химическом эквиваленте и эквивалентной массе простых и сложных веществ. Закон химических эквивалентов.
Эквивалент – реальная или условная частица вещества, которая может замещать, присоединять или быть каким-либо другим способом эквивалентна одному иону водорода в ионнообменных реакциях или одному электрону в ОВР.
Пример.
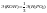
Эквивалентная масса элемента - это масса 1 эквивалента элемента.
Эквивалентная масса вещества - это масса 1 эквивалента вещества.
Другими словами, эквивалентная масса кислоты равна ее молярной массе, деленной на основность кислоты.
Пример.
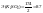
Закон химических эквивалентов. Массы реаг.вещ-в пропорциональны их экв.массам.
18.Полярность
связи. Полярность молекул и дипольный
момент.Предположим,
что мы имеем соединение АB. Оба элемента
с большими знач-миэлектроотрицательности
( ).=>
общая электронная пара в молекуле
смещена от атомаB к атомуА.Электронейтральность
нарушается,в мол-ле появл-ся полож-ный(B)
и отриц.(A)
полюса. Такая сист.наз-ся диполь–полярная
молекула
(сист.из 2-х разноименных,одинак.по
величине зарядов, нах-ся на малом
расстоянии). Ков.св.–полярная.Осн.харак-ка
диполя–дипольный
момент.
).=>
общая электронная пара в молекуле
смещена от атомаB к атомуА.Электронейтральность
нарушается,в мол-ле появл-ся полож-ный(B)
и отриц.(A)
полюса. Такая сист.наз-ся диполь–полярная
молекула
(сист.из 2-х разноименных,одинак.по
величине зарядов, нах-ся на малом
расстоянии). Ков.св.–полярная.Осн.харак-ка
диполя–дипольный
момент.
 -напряж.поля,созд.диполем.
-напряж.поля,созд.диполем.
l–плечо
диполя.Примеры полярных молекул-диполей:
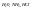 и др.Чем больше плечо, тем полярнее
молекула.
и др.Чем больше плечо, тем полярнее
молекула. можно представить как произведение
некоторой величины D
(единицы
Дебая)
на
можно представить как произведение
некоторой величины D
(единицы
Дебая)
на
 Для
ионных соед.D=4-11
единиц, для полярных D=0-4
единиц.Полярность
св.–
вектор, напр-ный от отриц-го полюса к
полож-му, происходит взаимное уничтожение
векторов.
Для
ионных соед.D=4-11
единиц, для полярных D=0-4
единиц.Полярность
св.–
вектор, напр-ный от отриц-го полюса к
полож-му, происходит взаимное уничтожение
векторов.
6. Основные стехиометрические законы.
1. З.постоянства состава: в-во имеет постоянный состав независимо от способа его получения.
Пример. 2H2+O2=2H2O и 4NH3+3O2=6H2O+2N.
2. З.эквивалентов: в-ва вступают в хим. взаимодействие и замещают друг друга в соед.в весовых количествах пропорциональным хим. эквивалентам этих веществ.Хим.эквивалент - такое весовое кол-во в-ва, которое реагирует с 1.008 весовых частей H2 или 8 в.ч. О2.
3. З. простых кратных отношений: если два элемента образуют несколько соединений, то на одно и тоже весовое кол-во одного элемента приходится такие весовые кол-ва другого элемента, которые относятся между собой, как простые целые числа.Пример: H20/H2O2 , CO/CO2, N2O/NO/N2O3/NO2/N2O4/N2O5.
4. З. сохранения массы и энергии: в изолированной сист. сумма m-c и E-й постоянна.
5. З. Авогадро: в равных объемах всех газов при одинаковых давлении и температуре содержится одинаковое число молекул.
В
одном моле содержится