
- •10. Связь периодич-го з. Со строением эл-ных оболочек атомов. Пр. Клечковского. Энергетич. Ячейки. Правило Хунда.
- •8. Волновые свойства электрона. Квантовые числа,s-, p-,d-,f-состояния электронов. Электронные орбитали.
- •9. Принцип Паули. Емкость энергетических уровней и подуровней атомов элементов.
- •16.Ионная (электронная связь).
- •15.Направленность ковалентной связи ᵹ- и π-связи. Гибридизация атомных орбиталей.
- •19.Донорно-акцепторный механизм ков.Св.. Комплексные соединения.
- •17. Представление о методе молекулярных орбиталей.
- •14. Ков.(атомная) св.. Метод валентных связей. Возбужденные состояния атомов. Валентность.
- •13.Образование химической связи. Энергия и длина связи.
- •11. Периодич.З.Д.И.Менделеева и периодич.Сист. Эл-ов: ряды, периоды, группы, подгруппы, порядковый номер эл-та.
- •7. З.Хим.Экв-ов. Молярные экв-ные массы сложных в-в.
- •3. Понятие о химическом эквиваленте и эквивалентной массе простых и сложных веществ. Закон химических эквивалентов.
- •6. Основные стехиометрические законы.
- •5. Основные газовые законы. Определение молекулярных масс газообразных веществ.
- •21. Система. Фаза. Компонент. Параметры. Функции состояния: внутренняя энергия и энтальпия. Стандартные условия.
- •22. Первое начало термодинамики. Закон Гесса как следствие первого начала термодинамики. Термохимические расчеты.
- •27. Объединенная формула первого и второго начала термодинамики. Свободная энергия Гиббса и Гельмгольца.Первый закон.
- •29.Условия самопроизвольного протекания химических реакций.
- •34.Скорость химической реакции. Закон действующих масс. Константа скорости.
- •36. .Кинетическая классификация по степени сложности. Обратимые и необратимые реакции.
- •41. Дисперсные системы. Коллоидные растворы.
- •37 .Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса
- •44. Растворимость газов в жидкостях. Закон Генри-Дальтона. Закон распределения.
- •50.Произведение растворимости.
- •12. Периодическое изменение свойств химических элементов. Радиус атомов, сродство электрону,
- •57.Электролиз. Последовательность разряда ионов на катоде и аноде.
- •3) Ме,стоящие в ряду напр-я посла водорода
- •59.Классификация химических источников тока.
- •60. Коррозия металлов. Химическая и электрохимическая коррозия.
- •61. Основные методы борьбы с коррозией.
- •62. Кристаллическое состояние вещества. Химическая связь в кристаллах.
- •64.Сущн-ть физико-химич.Анализа.Пр-ло фаз.Диаграмма состояния воды.
- •67.Адсорбция и абсорбция.
- •64. Основные принципы построения диаграммы плавкости бинарных систем.
- •1. Принцип непрерывности.
- •2. Принцип соответствия.
- •65. Эвтектическая диаграмма плавкости (без образования твердых растворов).
44. Растворимость газов в жидкостях. Закон Генри-Дальтона. Закон распределения.
З.Генри-Дальтона:При
некотором определенном давлении и
постоянной температуре растворяется
в жидкости определенное количество
газа, зависящее также и от свойств
жидкости. При увеличении или уменьшении
давления газовой атмосферы на жидкость
с сохранением той же температуры
увеличивается или уменьшается в таком
же отношении количество растворенного
газа.
Согласно
закону распределения, вещество,
растворенное в двух несмешивающихся
или ограниченно смешивающихся жидкостях,
распределяется между ними в постоянном
отношении. Это отношение для идеальных
систем зависит только от температуры,
природы вещества и не зависит от
концентрации. Из этого закона следует,
что при одновременном растворении
нескольких веществ каждое из них
распределяется между обеими жидкими
фазами таким образом, как будто в системе
нет никаких других веществ, подлежащих
распределению. Закон распределения
справедлив лишь в том случае, если
распределяемое вещество в обеих фазах
находится в одной и той же форме. Константа
распределения вещества. Постоянная
величина, выражающая отношение
концентраций распределяемого вещества,
находящегося в обеих фазах (после
наступления равновесия) в одной и той
же форме, называется константой
распределения:

где Р о — константа распределения: [А] о —концентрация вещества в фазе органического растворителя, моль/л; [А] В — концентрация вещества в водной фазе, моль/л.
45.Законы
Рауля.Особенность
растворов: давление пара растворителя
над раствором ниже, чем над чистым
растворителем. Первый
закон.Давление
пара растворителя над раствором
пропорционально мольной доле растворителя
в растворе.или Относительно понижение
давление пара растворителя над раствором
равно мольной доли растворенного
вещества.Введем обозначения: давление пара растворителя над чистым
растворителем;
давление пара растворителя над чистым
растворителем;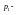 давление пара растворителя над раствором;
давление пара растворителя над раствором; абсолютное понижение давления;
абсолютное понижение давления;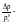 относительное понижение давления.
относительное понижение давления.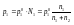
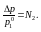 Если
система полностью подчиняется закону,
на графике наблюдаются прямолинейные
зависимости.
Если
система полностью подчиняется закону,
на графике наблюдаются прямолинейные
зависимости.

Однако
в реальных системах наблюдаются
отклонения. Температура замерзания
раствора ниже температуры замерзания
чистого растворителя, а температура
кипения – выше.Второй
закон.Повышение
температуры кипения раствора и понижение
температуры его замерзания пропорциональны
моляльной концентрации раствора.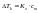
 К – константа, характеризующая
растворитель.
К – константа, характеризующая
растворитель. не зависит от природы вещества, а
определяется природой растворителя и
моляльностью, т.е. числом растворенных
молекул в определенном количестве
растворителя.С помощью законов Рауля
можно определять неизвестные молекулярные
массы растворенных веществ.
не зависит от природы вещества, а
определяется природой растворителя и
моляльностью, т.е. числом растворенных
молекул в определенном количестве
растворителя.С помощью законов Рауля
можно определять неизвестные молекулярные
массы растворенных веществ.
46.Электролитическая
диссоциация. Степень диссоциации. Слабые
электролиты.Электролиты
– вещества, которые в растворе или
расплаве состоят полностью или частично
из ионов.Они не подчиняются законам
Рауля: их растворы замерзают при более
низких температурах, а кипят при более
высоких температурах, чем растворы
неэлектролитов той же моляльной
концентрации.Электролитическая
диссоциация.Теорию
ЭД предложил шведский ученый Аррениус.
«Электролиты, растворяясть в воде,
распадаются на ионы (заряженные частицы).
При этом каждый ион ведет себя как
самостоятельная частица.В результате
диссоциации концентрация увеличивается
(число частиц в единице объема).»Академик
Каблуков дополнил теорию ЭД: «основная
причина диссоциации на ионы –
взаимодействие с полярными молекулами
воды».Согласно закону Кулона, сила
притяжения между зарядами
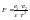
 показывает, во сколько раз сила в данной
среде меньше, чем в вакууме.Об ионизирующей
способности растворителей судят по их
диэлектрической проницаемости: чем она
выше, тем энергичнее протекает процесс
ЭД.Кроме воды, электролиты диссоциируют
в
показывает, во сколько раз сила в данной
среде меньше, чем в вакууме.Об ионизирующей
способности растворителей судят по их
диэлектрической проницаемости: чем она
выше, тем энергичнее протекает процесс
ЭД.Кроме воды, электролиты диссоциируют
в
 По способности диссоциации электролиты
делятся на слабые
и сильные.
Сильные диссоциируют полностью –
процесс необратим. Процесс диссоциации
слабых обратим (в растворах содержатся
как ионы, так и недиссоциированные
молекулы).Степень
диссоциации
- доля растворенного электролита,
распавшегося на ионы. Для сильных -
По способности диссоциации электролиты
делятся на слабые
и сильные.
Сильные диссоциируют полностью –
процесс необратим. Процесс диссоциации
слабых обратим (в растворах содержатся
как ионы, так и недиссоциированные
молекулы).Степень
диссоциации
- доля растворенного электролита,
распавшегося на ионы. Для сильных -
 для слабых
для слабых
 На практике СД определяют путем измерения
электропроводимости раствора. Различают
удельную электропроводимость
На практике СД определяют путем измерения
электропроводимости раствора. Различают
удельную электропроводимость
 и эквивалентную
и эквивалентную
 повышается с увеличением разбавления
до некоторой предельной величины, когда
все молекулы распадаются на ионы
повышается с увеличением разбавления
до некоторой предельной величины, когда
все молекулы распадаются на ионы
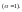 При этом предельное значение эквивалентной
электропроводимости – электропроводимость
при бесконечном разбавлении
-
При этом предельное значение эквивалентной
электропроводимости – электропроводимость
при бесконечном разбавлении
-
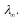 Для слабых электролитов выполняется
Для слабых электролитов выполняется
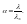
46.
Константа диссоциации. Закон разведения
Оствальда.Электролитическая
диссоциация.Теорию
ЭД предложил шведский ученый Аррениус.
«Электролиты, растворяясть в воде,
распадаются на ионы (заряженные частицы).
При этом каждый ион ведет себя как
самостоятельная частица.В результате
диссоциации концентрация увеличивается
(число частиц в единице объема).»Академик
Каблуков дополнил теорию ЭД: «основная
причина диссоциации на ионы –
взаимодействие с полярными молекулами
воды».Согласно закону Кулона, сила
притяжения между зарядами
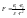 показывает, во сколько раз сила в данной
среде меньше, чем в вакууме.Об ионизирующей
способности растворителей судят по их
диэлектрической проницаемости: чем она
выше, тем энергичнее протекает процесс
ЭД.Кроме воды, электролиты диссоциируют
в
показывает, во сколько раз сила в данной
среде меньше, чем в вакууме.Об ионизирующей
способности растворителей судят по их
диэлектрической проницаемости: чем она
выше, тем энергичнее протекает процесс
ЭД.Кроме воды, электролиты диссоциируют
в
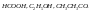 Константа
диссоциации в
случае разбавленного электролита:
Константа
диссоциации в
случае разбавленного электролита:

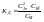 См – концентрация недиссоциированных
молекул.При стандартных условиях
См – концентрация недиссоциированных
молекул.При стандартных условиях
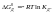 Константа
диссоциации
в одном и том же растворителе при
постоянной температуре – величина
постоянная, она свойственна данному
электролиту.Степень
диссоциации
характеризует состояние электролита
в растворе данной концентрации и меняется
с изменением ее.При повышении концентрации
раствора
Константа
диссоциации
в одном и том же растворителе при
постоянной температуре – величина
постоянная, она свойственна данному
электролиту.Степень
диссоциации
характеризует состояние электролита
в растворе данной концентрации и меняется
с изменением ее.При повышении концентрации
раствора
 уменьшается. Закон
разведения Оствальда.С
разбавлением раствора степень диссоциации
его увеличивается.Выражает зависимость
между
уменьшается. Закон
разведения Оствальда.С
разбавлением раствора степень диссоциации
его увеличивается.Выражает зависимость
между
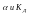
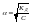 Также
можно установить связь и между
Также
можно установить связь и между

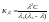 Сильные
электролиты: почти все соли, большинство
кислот и гидроксиды металлов.Электролиты
средней
силы:
Сильные
электролиты: почти все соли, большинство
кислот и гидроксиды металлов.Электролиты
средней
силы:
 Слабые
электролиты: почти все органические
кислоты, вода.
Слабые
электролиты: почти все органические
кислоты, вода.
47.
Сильные электролиты. Понятие активности
и коэффициента активности.Электролиты
– вещества, которые в растворе или
расплаве состоят полностью или частично
из ионов.Они не подчиняются законам
Рауля: их растворы замерзают при более
низких температурах, а кипят при более
высоких температурах, чем растворы
неэлектролитов той же моляльной
концентрации.По способности диссоциации
электролиты делятся на слабые
и сильные.
Сильные диссоциируют полностью –
процесс необратим. Процесс диссоциации
слабых обратим (в растворах содержатся
как ионы, так и недиссоциированные
молекулы).Сильные
электролиты не только в разбавленных,
но и в концентрированных растворах
диссоциируют практически нацело.Степень
диссоциации примерно равна 1.Если условно
взять какой-либо ион за центр и провести
вокруг сферу произвольного радиуса,
можно заметить, что каждый ион окружается
как бы роем других ионов – ионной
атмосферой.
Ионная атмосфера препятсвует передвижению
ионов в растворе, что приводит к уменьшению
электропроводимости раствора.Разбавление
увеличивает расстояния между ионами,
уменьшает из взаимодействие, что приводит
к увеличению электропроводности за
счет роста скорости ионов, а не за счет
роста степени диссоциации.Для растворов
сильных электролитов введено понятие
активности
(или активной концентрации). Активность
– величина, подстановка которой вместо
концентрации в термодинамические
уравнения, действительные для идеальных
систем, позволяет использовать их для
реальных систем.
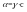 с – концентрация, «гамма» - коэффициент
активности.Активность учитывает все
виды взаимодействия между ионами. В
качестве стандартного
– принимают состояние полной диссоциации,
при отсутствии осложняющего воздействия
ионов друг на друга.
с – концентрация, «гамма» - коэффициент
активности.Активность учитывает все
виды взаимодействия между ионами. В
качестве стандартного
– принимают состояние полной диссоциации,
при отсутствии осложняющего воздействия
ионов друг на друга.
48.
Электролитическая
диссоциация воды. Ионное произведение
воды. Водородный показатель. Понятие
об индикаторах.Электролиты
– вещ-ва, которые в растворе или расплаве
состоят полностью или частично из
ионов.Они не подчиняются законам Рауля:
их растворы замерзают при более низких
темп-рах, а кипят при более высоких
темп-рах. Электролитическая
диссоциация.Теорию
ЭД предложил шведский ученый Аррениус.
«Электролиты, растворяясть в воде,
распадаются на ионы (заряженные частицы).
При этом каждый ион ведет себя как
самост.частица.В результате диссоциации
концентрация увелич-ся).»Академик
Каблуков дополнил теорию ЭД: «основная
причина диссоциации на ионы –
взаимодействие с полярными молекулами
воды».Согласно закону Кулона, сила
притяжения между зарядами
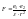 .Об
ионизирующей спос-сти растворителей
судят по их диэлектрической проницаемости:
чем она выше, тем энергичнее протекает
процесс ЭД.Кроме воды, электролиты
диссоциируют в
.Об
ионизирующей спос-сти растворителей
судят по их диэлектрической проницаемости:
чем она выше, тем энергичнее протекает
процесс ЭД.Кроме воды, электролиты
диссоциируют в
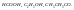 По способности диссоциации электролиты
делятся на слабые
и сильные.
Сильные диссоциируют полностью –
процесс необратим. Процесс диссоциации
слабых обратим (в растворах содержатся
как ионы, так и недиссоциированные
молекулы).Степень
диссоциации
- доля растворенного электролита,
распавшегося на ионы. Для сильных -
По способности диссоциации электролиты
делятся на слабые
и сильные.
Сильные диссоциируют полностью –
процесс необратим. Процесс диссоциации
слабых обратим (в растворах содержатся
как ионы, так и недиссоциированные
молекулы).Степень
диссоциации
- доля растворенного электролита,
распавшегося на ионы. Для сильных -
 для слабых
для слабых
 На практике СД определяют путем измерения
электропроводимости раствора. Различают
удельную электропроводимость
и эквивалентную
На практике СД определяют путем измерения
электропроводимости раствора. Различают
удельную электропроводимость
и эквивалентную

 повышается с увеличением разбавления
до некоторой предельной величины, когда
все молекулы распадаются на ионы
повышается с увеличением разбавления
до некоторой предельной величины, когда
все молекулы распадаются на ионы
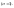 При этом предельное знач.экв-ной
электропроводимости – электропроводимость
при бесконечном разбавлении
-
При этом предельное знач.экв-ной
электропроводимости – электропроводимость
при бесконечном разбавлении
-
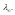 Для слабых электролитов выполняется
Для слабых электролитов выполняется
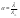
49.Гидролиз солей. Константа и степень гидролиза.Гидролиз - разложение солей под действием воды.Вторая формулировка. Процесс, обратный нейтрализации, приводящий к образованию кислоты и основания.Нейтрализация – реакция между кислотой и основанием.1. Гидролиза нет
-если сильное основание и сильная кислота.
-если нерастворимые вещества («н» в таблице).
Пример.

2. Полный гидролиз
-если слабая кислота и слабое основание.
-если «-» в таблице растворимости.
Пример.
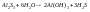
3. -если сильное основание и слабая кислота.
-если слабое основание и сильная кислота.
Пример.

Константа
гидролиза:

Степень гидролиза – применяется для характеристики реакций гидролиза.
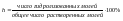
Степень возрастает с ростом температуры и с уменьшением концентрации (разбавлением).
