
- •10. Связь периодич-го з. Со строением эл-ных оболочек атомов. Пр. Клечковского. Энергетич. Ячейки. Правило Хунда.
- •8. Волновые свойства электрона. Квантовые числа,s-, p-,d-,f-состояния электронов. Электронные орбитали.
- •9. Принцип Паули. Емкость энергетических уровней и подуровней атомов элементов.
- •16.Ионная (электронная связь).
- •15.Направленность ковалентной связи ᵹ- и π-связи. Гибридизация атомных орбиталей.
- •19.Донорно-акцепторный механизм ков.Св.. Комплексные соединения.
- •17. Представление о методе молекулярных орбиталей.
- •14. Ков.(атомная) св.. Метод валентных связей. Возбужденные состояния атомов. Валентность.
- •13.Образование химической связи. Энергия и длина связи.
- •11. Периодич.З.Д.И.Менделеева и периодич.Сист. Эл-ов: ряды, периоды, группы, подгруппы, порядковый номер эл-та.
- •7. З.Хим.Экв-ов. Молярные экв-ные массы сложных в-в.
- •3. Понятие о химическом эквиваленте и эквивалентной массе простых и сложных веществ. Закон химических эквивалентов.
- •6. Основные стехиометрические законы.
- •5. Основные газовые законы. Определение молекулярных масс газообразных веществ.
- •21. Система. Фаза. Компонент. Параметры. Функции состояния: внутренняя энергия и энтальпия. Стандартные условия.
- •22. Первое начало термодинамики. Закон Гесса как следствие первого начала термодинамики. Термохимические расчеты.
- •27. Объединенная формула первого и второго начала термодинамики. Свободная энергия Гиббса и Гельмгольца.Первый закон.
- •29.Условия самопроизвольного протекания химических реакций.
- •34.Скорость химической реакции. Закон действующих масс. Константа скорости.
- •36. .Кинетическая классификация по степени сложности. Обратимые и необратимые реакции.
- •41. Дисперсные системы. Коллоидные растворы.
- •37 .Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса
- •44. Растворимость газов в жидкостях. Закон Генри-Дальтона. Закон распределения.
- •50.Произведение растворимости.
- •12. Периодическое изменение свойств химических элементов. Радиус атомов, сродство электрону,
- •57.Электролиз. Последовательность разряда ионов на катоде и аноде.
- •3) Ме,стоящие в ряду напр-я посла водорода
- •59.Классификация химических источников тока.
- •60. Коррозия металлов. Химическая и электрохимическая коррозия.
- •61. Основные методы борьбы с коррозией.
- •62. Кристаллическое состояние вещества. Химическая связь в кристаллах.
- •64.Сущн-ть физико-химич.Анализа.Пр-ло фаз.Диаграмма состояния воды.
- •67.Адсорбция и абсорбция.
- •64. Основные принципы построения диаграммы плавкости бинарных систем.
- •1. Принцип непрерывности.
- •2. Принцип соответствия.
- •65. Эвтектическая диаграмма плавкости (без образования твердых растворов).
16.Ионная (электронная связь).
В
случае возникновения ионной связи между
атомами или группами атомов преобладает
электростатическое взаимодействие.
Она возникает
между атомами элементов, значительно
отличающихся по величине
электроотрицательности.
Элементы, входящие в состав ионного соединения, всегда существуют в виде ионов, а не нейтральных атомов. Также нужно отметить, что полного разделения зарядов нет и имеет место частичная ковалентность.Валентность в ионных соединениях определяется по числу зарядов слагающих их ионов.Ионы проводят электр. ток в растворах и расплавах и являются проводниками второго рода.
15.Направленность ковалентной связи ᵹ- и π-связи. Гибридизация атомных орбиталей.
Гибридизация атомных орбиталей.К.с. возникает м/у элементами с одинаковым или близким знач-м эн.сродства к эл-ну.Перекрывание облаков при обр-нии к.с. возможно только при опред.их взаимной ориентации в пространстве – отсюда направл-ть связей, приводящая к опред. форме молекул. При этом обл. перекрывания расп-ся опр-м обр-м по отн-ю к взаимодейств-м атомам. 1.Молекулы типа AA, BB, АВ.Характерен для водорода, галогенов и соед. «галоген+водород». Молекулы имеют линейчатую структуру. Хим.св. действ.по кратчайш.расстоянию(сигма-связь).2.Молекулы типа A2B.Характерен для соед., образ-х элем-ми главной подгруппы 6-ой группы: Н2О, Н2S,H2O-валентный угол 1050H2S-валентный угол92033’ 3. Молекулы типаA3B. Характерен для соед., образ-х элем-ми гл.подгр.5-й группы (N, P, As, Sb, Bi).Мол-ла аммиака (NH3) имеет форму пирамиду с треуг-м основании.4.Молекулы типа A4B. Гл.подгр.4-й гр.(Si,C,Ge,Sn, Pb)Молекула метана имеет форму тетраэдра (по вершинам – атомы водорода, атом углерода –в центре).5. Молекулы типа AB3.Гл.подгруппа 3-ей гр.(B,Al,Ga,In, Tl). Мол-лаBCl3имеет вид равностор.треуг-ка.6.Мол-лы типа AB2.Хар-рен для некоторых соед., образ-ми элем-ми гл.подгруппы 2гр.. ВеCl2(линейн.структура, угол–180).Если в мол-ле имеется кратная связь м/у атомами (2-ная или 3-ная),то только одна связь яв-ся прочной-пи-связь.Остальные–сигма-связи. Пример.Рассм. мол-лу этилена (С2Н4). неполная гибридизация М/у атомами углерода одна из связей «пи». Все остальне– «сигма».
19.Донорно-акцепторный механизм ков.Св.. Комплексные соединения.
Донорно-акцепторная
связь (ДАС) – разновидность ковалентной
связи. Выделяют соед.1-го
порядка(или
валентно-насыщенные соед.) Пример: H2O,
AgCl, NH3, HCl, KJ, CuSO4, FeCl3 и т.д. Реагируя друг
с другом дают соед.высшего
порядка (или компл.соед.).
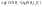
 В
компл.соед-х проявляются ДАС. Рассмотрим
пример:
В
компл.соед-х проявляются ДАС. Рассмотрим
пример:
Азот
в NH3
– донор, водород в HCl–акцептор.
Компл.соед.–соед.высшего
порядка, возн-е из соед-й1-го порядка без
образования новых электронных пар, а
за счет проявления хотя бы одной ДАС.
Предложено 2
теории возникн-я компл.соед-й.1-я–Полин–теория
вал-х св-й.
Комлексообразователь,координирующий
лиганды вокруг себя, имеет вакантные
орбитали.Т.е.образ-е компл.соед-1–результат
проявления ДАС,Вторая–Бете теория
кристаллического поля.Связь
в комплексах–электростатич-я,т.е.
взаимод. типа «ион-ион»или«ион-диполь». Конст.равновесия
(нестойкости) К
Конст.равновесия
(нестойкости) К Чем<значение Кн,тем прочнее компл-й
ион.
Чем<значение Кн,тем прочнее компл-й
ион.
