- •10. Связь периодич-го з. Со строением эл-ных оболочек атомов. Пр. Клечковского. Энергетич. Ячейки. Правило Хунда.
- •8. Волновые свойства электрона. Квантовые числа,s-, p-,d-,f-состояния электронов. Электронные орбитали.
- •9. Принцип Паули. Емкость энергетических уровней и подуровней атомов элементов.
- •16.Ионная (электронная связь).
- •15.Направленность ковалентной связи ᵹ- и π-связи. Гибридизация атомных орбиталей.
- •19.Донорно-акцепторный механизм ков.Св.. Комплексные соединения.
- •17. Представление о методе молекулярных орбиталей.
- •14. Ков.(атомная) св.. Метод валентных связей. Возбужденные состояния атомов. Валентность.
- •13.Образование химической связи. Энергия и длина связи.
- •11. Периодич.З.Д.И.Менделеева и периодич.Сист. Эл-ов: ряды, периоды, группы, подгруппы, порядковый номер эл-та.
- •7. З.Хим.Экв-ов. Молярные экв-ные массы сложных в-в.
- •3. Понятие о химическом эквиваленте и эквивалентной массе простых и сложных веществ. Закон химических эквивалентов.
- •6. Основные стехиометрические законы.
- •5. Основные газовые законы. Определение молекулярных масс газообразных веществ.
- •21. Система. Фаза. Компонент. Параметры. Функции состояния: внутренняя энергия и энтальпия. Стандартные условия.
- •22. Первое начало термодинамики. Закон Гесса как следствие первого начала термодинамики. Термохимические расчеты.
- •27. Объединенная формула первого и второго начала термодинамики. Свободная энергия Гиббса и Гельмгольца.Первый закон.
- •29.Условия самопроизвольного протекания химических реакций.
- •34.Скорость химической реакции. Закон действующих масс. Константа скорости.
- •36. .Кинетическая классификация по степени сложности. Обратимые и необратимые реакции.
- •41. Дисперсные системы. Коллоидные растворы.
- •37 .Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса
- •44. Растворимость газов в жидкостях. Закон Генри-Дальтона. Закон распределения.
- •50.Произведение растворимости.
- •12. Периодическое изменение свойств химических элементов. Радиус атомов, сродство электрону,
- •57.Электролиз. Последовательность разряда ионов на катоде и аноде.
- •3) Ме,стоящие в ряду напр-я посла водорода
- •59.Классификация химических источников тока.
- •60. Коррозия металлов. Химическая и электрохимическая коррозия.
- •61. Основные методы борьбы с коррозией.
- •62. Кристаллическое состояние вещества. Химическая связь в кристаллах.
- •64.Сущн-ть физико-химич.Анализа.Пр-ло фаз.Диаграмма состояния воды.
- •67.Адсорбция и абсорбция.
- •64. Основные принципы построения диаграммы плавкости бинарных систем.
- •1. Принцип непрерывности.
- •2. Принцип соответствия.
- •65. Эвтектическая диаграмма плавкости (без образования твердых растворов).
5. Основные газовые законы. Определение молекулярных масс газообразных веществ.
К
осн. газовому з. относится уравнение
состояния газа (уравнение
Менделеева-Клапейрона):
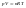
Газ, который подчиняется этому закону, называется идеальным.
Закон Авогадро.
В равных V-ах всех газов при одинаковых давлении и температуре содержится одинаковое число молекул.
Следствие1: одинаковое число молекул различных газов при одинаковых усл-х занимают одинаковый объем
В
одном моле содержится
При норм.усл. моль газа занимает 22,4
л.Универсальный газовый з.
Для опр.отн.молекулярной массы в-ва обычно находят численно =ую ей мольную массу в-ва.
Единица молекулярной массы - 1/12 часть массы молекулы углерода, условно принятой равной 12.
Масса газообразных веществ опр.по з.Авогадро и уравнению Менделеева-Клапейрона.
20.Межмолекулярное взаимодействие. Водородная связь.Водородная связь наблюдается при взаимодействии атома водорода с атомами сильно электроотрицательных элементов–F,O,N,Cl,S.Природа этой связи до конца не изучена: проявление сил межмолекулярного взаимодействия, но характер сил – электростатический.В случае возникновения водородной связи водород ведет себя как двухвалентный элемент.Наличие водородных связей объясняет так называемые аномальные свойства воды:1. макс. плотность при температуре +4.
2. вода обладает наибольшей теплоемкостью из известных жидкостей.
При
нагреве воды значительная часть энергии
затрачивается на разрыв связей, отсюда
и повышенная теплоемкость.Между
молекулами в газах, жидкостях и твердых
телах действуют одновременно силы
отталкивания и притяжения.Проявление
сил отталкивания
– результат взаимодействия заполненных
электронных оболочек, эти силы действуют
на очень малых расстояниях и быстро
убывают с увеличением расстояния.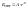 A
и n
(12) – эмпирические константы, r
– расстояние между частицами.Теоретически
лучше изложены силы притяжения.
Различают ориентационное, индукционное
и дисперсионное взаимодействия.Ориентационное.
Имеет место между молекулами – ярко
выраженными диполями.
A
и n
(12) – эмпирические константы, r
– расстояние между частицами.Теоретически
лучше изложены силы притяжения.
Различают ориентационное, индукционное
и дисперсионное взаимодействия.Ориентационное.
Имеет место между молекулами – ярко
выраженными диполями. k
– константа Больцмана, «ню» - дипольные
моменты молекул.Индукционное.
Если одна из молекул полярна, вторая –
неполярна, но легко поляризуема.
k
– константа Больцмана, «ню» - дипольные
моменты молекул.Индукционное.
Если одна из молекул полярна, вторая –
неполярна, но легко поляризуема.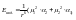 «альфа»
- коэффициент поляризации.Дисперсионное.
Возникновение мгновенных диполей.
«альфа»
- коэффициент поляризации.Дисперсионное.
Возникновение мгновенных диполей.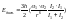 I
– потенциал ионизации, h
– постоянная Планка.В общем силы
притяжения могут быть представлены как
I
– потенциал ионизации, h
– постоянная Планка.В общем силы
притяжения могут быть представлены как
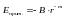 B
и m
(6) – константы.Суммарная энергия
B
и m
(6) – константы.Суммарная энергия

21. Система. Фаза. Компонент. Параметры. Функции состояния: внутренняя энергия и энтальпия. Стандартные условия.
Система - это тело или группа тел, находящихся в взаимодействии, которые мысленно выделены из окружающей среды. Бывают гомогенными (однородные) и гетерогенными (неоднородные).
Изолированная система не имеет обмена веществом и энергией с окружающей средой.
Закрытая – не имеет только массообмена.
Открытая – имеет и энерго- и массообмен.
Фаза - совокупность всех гомогенных частей системы, одинаковых по составу и всем физ. и хим. свойствам, не зависящим от количества вещества. Фазы отделены друг от друга поверхностями раздела, на которых все свойства фазы резко скачком меняются.
Компоненты – сост-е части системы, химически индивидуальные вещества, составляющие данную систему и способные к самостоятельному существованию, будучи изолироваными от других частей системы.
Состояние системы определяется набором переменных величин - параметров. Различают параметры интенсивные и экстенсивные. Интенсивные - не зависят от массы или числа частиц в-ва. (P,T), а экстенсивные - зависят (V, E).
Функции
состояния - это термодинамические
функции, значения которых зависят только
от состояния системы и не зависят от
пути по которому система пришла в данное
состояние. Изменение функции состояния

Наиболее
важными функциями являются внутренняя
энергия
системы U и энтальпия
(теплосодержание)

Внутр. энергия – общий запас энергии : энергия поступательного и вращательного движения, энергия колебаний, внутриядерная энергия, за исключением кинетической энергии системы в целом и потенциальной энергии положения системы.
Большое количество характеристик в химии зависят от условий, при которых они определяются. Наиболее общими и важными условиями являются температура и давление.
Стандартное
давление -
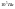
Стандартная температура – 298 К.
23. Стандартная энтальпия образования. Следствия из закона Гесса.Русский ученый Гесс (1840) дал формулировку основному закону термохимии: тепловой эффект реакции, протекающей при постоянном объеме или при постоянном давлении, не зависит от пути реакции (от ее промежуточных стадий), а определяется только природой и состоянием исходных веществ и продуктов реакции.Следствия из закона Гесса:1. тепловой эффект реакции равен разности между суммой теплот горения исходных веществ и суммой теплот горения продуктов реакции.Теплота горения – тепловой эффект реакции окисления данного соединения кислородом с образованием высших оксидов.Теплота образования – тепловой эффект реакции образования данного соединения из простых веществ.ю отвечающих наиболее устойчивому состоянию элементов при данных температуре и давлении.
2. тепловой эффект реакции равен разности между теплотами образования всех веществ, указанных в правой части уравнения, и теплотами образования веществ в левой части уравнения, взятых с коэффициентами перед формулами этих веществ в уравнении самой реакции.В настоящее время известны теплоты образования свыше 6000 веществ.Стандартные теплоты образования – величины теплот образования к температуре 298К и давлению 1атм
24.
Зависимость теплового эффекта химической
реакции от температуры (закон
Кирхгофа).Температурный
коэффициент теплового эффекта процесса
равен изменению теплоемкости системы,
происходящему в результате процесса
(закон Кирхгоффа).

Чтобы подсчитать тепловой эффект процесса при некоторой температуре Т2, нужно знать тепловой эффект процесса при Т1, а также характер изменения теплоемкости системы в интервале температур Т1-Т2.
Обычно в роли Т1 выступает стандартная температура 298К.