
- •10. Связь периодич-го з. Со строением эл-ных оболочек атомов. Пр. Клечковского. Энергетич. Ячейки. Правило Хунда.
- •8. Волновые свойства электрона. Квантовые числа,s-, p-,d-,f-состояния электронов. Электронные орбитали.
- •9. Принцип Паули. Емкость энергетических уровней и подуровней атомов элементов.
- •16.Ионная (электронная связь).
- •15.Направленность ковалентной связи ᵹ- и π-связи. Гибридизация атомных орбиталей.
- •19.Донорно-акцепторный механизм ков.Св.. Комплексные соединения.
- •17. Представление о методе молекулярных орбиталей.
- •14. Ков.(атомная) св.. Метод валентных связей. Возбужденные состояния атомов. Валентность.
- •13.Образование химической связи. Энергия и длина связи.
- •11. Периодич.З.Д.И.Менделеева и периодич.Сист. Эл-ов: ряды, периоды, группы, подгруппы, порядковый номер эл-та.
- •7. З.Хим.Экв-ов. Молярные экв-ные массы сложных в-в.
- •3. Понятие о химическом эквиваленте и эквивалентной массе простых и сложных веществ. Закон химических эквивалентов.
- •6. Основные стехиометрические законы.
- •5. Основные газовые законы. Определение молекулярных масс газообразных веществ.
- •21. Система. Фаза. Компонент. Параметры. Функции состояния: внутренняя энергия и энтальпия. Стандартные условия.
- •22. Первое начало термодинамики. Закон Гесса как следствие первого начала термодинамики. Термохимические расчеты.
- •27. Объединенная формула первого и второго начала термодинамики. Свободная энергия Гиббса и Гельмгольца.Первый закон.
- •29.Условия самопроизвольного протекания химических реакций.
- •34.Скорость химической реакции. Закон действующих масс. Константа скорости.
- •36. .Кинетическая классификация по степени сложности. Обратимые и необратимые реакции.
- •41. Дисперсные системы. Коллоидные растворы.
- •37 .Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса
- •44. Растворимость газов в жидкостях. Закон Генри-Дальтона. Закон распределения.
- •50.Произведение растворимости.
- •12. Периодическое изменение свойств химических элементов. Радиус атомов, сродство электрону,
- •57.Электролиз. Последовательность разряда ионов на катоде и аноде.
- •3) Ме,стоящие в ряду напр-я посла водорода
- •59.Классификация химических источников тока.
- •60. Коррозия металлов. Химическая и электрохимическая коррозия.
- •61. Основные методы борьбы с коррозией.
- •62. Кристаллическое состояние вещества. Химическая связь в кристаллах.
- •64.Сущн-ть физико-химич.Анализа.Пр-ло фаз.Диаграмма состояния воды.
- •67.Адсорбция и абсорбция.
- •64. Основные принципы построения диаграммы плавкости бинарных систем.
- •1. Принцип непрерывности.
- •2. Принцип соответствия.
- •65. Эвтектическая диаграмма плавкости (без образования твердых растворов).
57.Электролиз. Последовательность разряда ионов на катоде и аноде.
Электролиз - это окислительно-восстановительный процесс, протекающий при прохождении постоянного тока через раствор или расплав электролита.
Сущность электролиза: на катоде(-) идет процесс восстановления, на аноде(+) – процесс окисления.
Пример.
![]()
Посл-ть разряда ионов в водном р-ре:
Вода-слабый электролит: H2O=H++(OH)-
На «-« катода в первую очередь восстан-ся тот катион,потенциал к-го более «+»,поэтому различают 3 группы:
1) От Li до Al (вкл-но)
В водных р-рах эти ме не выделить электролизом,т.к.они не могут конкурировать с катионами водорода, поэтому на катоде происходит восст-е ионов водорода:
(-к) : Н++2е=Н2, рН<7
(-к): 2H2O+2e=H2 +2(OH)-, pH≥7
2) от Mn2+ до Fe3+
3) Ме,стоящие в ряду напр-я посла водорода
При электролизе на (-к) выдел-ся только ме ; процессы на аноде: в водных р-рах в первую очередь окисляется анион, потенциал к-го <. Возможны 2 случая:
1) анод «+»-нерастворимый(т.е.инертный).Платина,золото.Окисляются ионы безкислоро.кислот(фтор,бром,йод). Если водный р-р,то F невозможно выделить.
![]()
![]()
Если этих ионов нет,то выделяется кислород:
2(ОН)- - 2е= Н2О+1/2O2 , pH>7
H2O-2e=1/2 O2+2H, pH≤7
Нек-ые ме прктически не раствор-ся на аноде из за их высокой поляризации.(никель и железо в щелочной ср).Если ме растворимый, то на аноде он окисл-ся и переходит в р-р: Ме0-ne=Меn+
Явл-е торможения ме происъодит из-за образ-я хащитных слоев : nMe++2m(OH)-=MenOm+mH2O+2ne
Анодная пассивация ме имеет большое практическое знач-е.
Железо и никель покрыв-ся плотной оксидной пленкой.
Полезное действие анодной пассивации: соз-ся оксид.пленка,защитная,антикоррозионная.(Al, Mg, Fe)
Вредное воздействии: если необходимо вести пр-сы с анодом растворения ме(гальванотехника,пр-с рафинирования).
Факторы,усиливающие пассивность:
1)повыш-е пл-ти тока и вр-ни
2)пониж-е темп-ры
3)наличие ионов с малой ПР
Если малая ПР, то на аноде обр-ся защитная пленка из плохорастворимого соед-я.
Активаторы,нарушающие пассивность:
1) наличие восстанов-ей в р-ре
2) наличие хлора и брома
Ионы хлора замедляют коррозию,т.к.ионы хлора замещают в оксидах ме анионы кисл-да.
59.Классификация химических источников тока.
Существуют 3 типа ХИТ: первичные - гальванические элементы, вторичные – аккумуляторы и топливные элементы.
1)В гальванических элементах активные вещества, необходимые для работы элемента, закладываются в него при монтаже, после израсходования веществ элемент утилизируется(одноразовые батарейки)
2)В основу аккумулятора положена высоко-обратимая хим реакция окисления-восстановления, которую можно проводить в обоих направлениях.
3)Топливный элемент – это ХИТ длительного действия, начинающий и прекращающий работу с началом и прекращением подачи активных веществ в электродам.
Достоинства ХИТ: высокий КПД, экологическая чистота, бесшумность, автономность действия.
Недостаток – низкие удельные характеристики.
Марганцево-цинковый элемент: наиболее широко применяется среди первичных ХИТ.
Электрохимическая цепь: (-)Zn|NH4Cl|MnO2(+). Электролит – 20% раствор NH4Cl, загущенный до студнеобразного состояния, для предотвращения высыхания и загнивания вводят специальные добавки. MnO2 спрессован с добавкой сажи – для увеличения электроемкости. ЭДС от 1,48 до 1,8 в зависимости от кристаллической модификации MnO2, начальное напряжение 1,1-1,25В. Процессы при разряде: (-) Zn-2ē+2H2O>Zn(OH)2+2H+, (+)2MnO2+2ē+2H+>2MnO.OH, Zn+2MnO2+2H2O=Zn(OH)2+2MnO.OH. Вторичная реакция: Zn(OH)2+2NH4Cl=[Zn(NH3)2]Cl2+2MnO.OH
58.Законы
Фарадея. Выход по току.Первый закон:
при электролизе данного электролита
количества веществ, выделяющихся на
электродах, прямо пропорционально
количеству электричества, прошедшему
через электролит.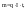 q
– электрохимический
эквивалент.Второй
закон:
при электролизе различных электролитов
одинаковые количества электричества
выделяют на электродах такие количества
веществ, которые прямо пропорциональны
их химическим эквивалентам.Пример. При
прохождении 1 фарадея (96500 Кл) электричества
на электродах выделяется 1 г-экв вещества.В
формулу первого закона следует ввести
поправочный сомножитель – выход по
току.Закон Фарадея:
q
– электрохимический
эквивалент.Второй
закон:
при электролизе различных электролитов
одинаковые количества электричества
выделяют на электродах такие количества
веществ, которые прямо пропорциональны
их химическим эквивалентам.Пример. При
прохождении 1 фарадея (96500 Кл) электричества
на электродах выделяется 1 г-экв вещества.В
формулу первого закона следует ввести
поправочный сомножитель – выход по
току.Закон Фарадея:
 Электрический
эквивалент
q
– количество вещества в мг, выделяющееся
на электродах при прохождении 1 Кл
электричества.Вторая
формулировка. Электрический эквивалент
q
– количество вещества в г, выделяющееся
на электродах при прохождении 1 А*ч
электричества.q=Э/Ф,
Э – г-экв.Удельный
расход энергии при электролизе:
W=U*I*t/m=U/(q*η),
[Вт*ч/г].
Электрический
эквивалент
q
– количество вещества в мг, выделяющееся
на электродах при прохождении 1 Кл
электричества.Вторая
формулировка. Электрический эквивалент
q
– количество вещества в г, выделяющееся
на электродах при прохождении 1 А*ч
электричества.q=Э/Ф,
Э – г-экв.Удельный
расход энергии при электролизе:
W=U*I*t/m=U/(q*η),
[Вт*ч/г].
