
- •10. Связь периодич-го з. Со строением эл-ных оболочек атомов. Пр. Клечковского. Энергетич. Ячейки. Правило Хунда.
- •8. Волновые свойства электрона. Квантовые числа,s-, p-,d-,f-состояния электронов. Электронные орбитали.
- •9. Принцип Паули. Емкость энергетических уровней и подуровней атомов элементов.
- •16.Ионная (электронная связь).
- •15.Направленность ковалентной связи ᵹ- и π-связи. Гибридизация атомных орбиталей.
- •19.Донорно-акцепторный механизм ков.Св.. Комплексные соединения.
- •17. Представление о методе молекулярных орбиталей.
- •14. Ков.(атомная) св.. Метод валентных связей. Возбужденные состояния атомов. Валентность.
- •13.Образование химической связи. Энергия и длина связи.
- •11. Периодич.З.Д.И.Менделеева и периодич.Сист. Эл-ов: ряды, периоды, группы, подгруппы, порядковый номер эл-та.
- •7. З.Хим.Экв-ов. Молярные экв-ные массы сложных в-в.
- •3. Понятие о химическом эквиваленте и эквивалентной массе простых и сложных веществ. Закон химических эквивалентов.
- •6. Основные стехиометрические законы.
- •5. Основные газовые законы. Определение молекулярных масс газообразных веществ.
- •21. Система. Фаза. Компонент. Параметры. Функции состояния: внутренняя энергия и энтальпия. Стандартные условия.
- •22. Первое начало термодинамики. Закон Гесса как следствие первого начала термодинамики. Термохимические расчеты.
- •27. Объединенная формула первого и второго начала термодинамики. Свободная энергия Гиббса и Гельмгольца.Первый закон.
- •29.Условия самопроизвольного протекания химических реакций.
- •34.Скорость химической реакции. Закон действующих масс. Константа скорости.
- •36. .Кинетическая классификация по степени сложности. Обратимые и необратимые реакции.
- •41. Дисперсные системы. Коллоидные растворы.
- •37 .Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса
- •44. Растворимость газов в жидкостях. Закон Генри-Дальтона. Закон распределения.
- •50.Произведение растворимости.
- •12. Периодическое изменение свойств химических элементов. Радиус атомов, сродство электрону,
- •57.Электролиз. Последовательность разряда ионов на катоде и аноде.
- •3) Ме,стоящие в ряду напр-я посла водорода
- •59.Классификация химических источников тока.
- •60. Коррозия металлов. Химическая и электрохимическая коррозия.
- •61. Основные методы борьбы с коррозией.
- •62. Кристаллическое состояние вещества. Химическая связь в кристаллах.
- •64.Сущн-ть физико-химич.Анализа.Пр-ло фаз.Диаграмма состояния воды.
- •67.Адсорбция и абсорбция.
- •64. Основные принципы построения диаграммы плавкости бинарных систем.
- •1. Принцип непрерывности.
- •2. Принцип соответствия.
- •65. Эвтектическая диаграмма плавкости (без образования твердых растворов).
Вопросы к экзамену по химии.
Оксиды. Основные химические свойства.
Кислоты. Основные химические свойства.
Основания. Основные химические свойства.
Соли. Основные химические свойства.
Основные газовые законы. Определение молекулярных масс газообразных веществ.
Основные стехиометрические законы.
Закон химических эквивалентов. Молярные массы эквивалентов сложных веществ.
Волновые свойства электрона. Квантовые числа s-, p-, d-, f-состояния электрона. Электронные орбитали.
Принцип Паули. Емкость энергетических уровней и подуровней атомов элементов.
Связь периодического закона со строением электронных оболочек атомов. Правило Клечковского. Энергетические ячейки. Правило Хунда.
Периодический закон Д. И. Менделеева и периодическая система элементов: ряды, периоды, группы, подгруппы, порядковый номер элемента.
Периодическое изменение свойств химических элементов. Радиус атомов, сродство к электрону, энергия ионизации, электроотрицательность.
Образование химической связи. Энергия и длина связи.
Ковалентная (атомная) связь. Метод валентных связей. Возбужденные состояния атомов. Валентность.
Направленность ковалентной связи ᵹ- и π-связи. Гибридизация атомных орбиталей.
Ионная(электронная) связь.
Представление о методе молекулярных орбиталей.
Полярность связи. Полярность молекул и дипольный момент.
Донорно-акцепторный механизм ковалентной связи. Комплексные соединения..
Межмолекулярное взаимодействие. Водородная связь.
Система. Фаза. Компонент. Параметры. Функции состояния: внутренняя энергия и энтальпия. Стандартные условия.
Первое начало термодинамики. Закон Гесса как следствие первого начала термодинамики. Термохимические расчеты.
Стандартная энтальпия образования. Следствия из закона Гесса.
Зависимость теплового эффекта химической реакции от температуры (закон Кирхгоффа).
Второе начало термодинамики. Понятие об энтропии. Расчет энтропии.
Постулат Планка. Стандартная энтропия веществ.
Объединенная формула первого и второго начала термодинамики. Свободная энергия Гиббса и Гельмгольца.
Зависимость F и G от температуры (уравнение Гиббса-Гельмгольца).
Условия самопроизвольного протекания химических реакций.
Изотерма химической реакции. Стандартное изменение свободной энергии.
Константа химического равновесия. Различные способы выражения констант равновесия. Соотношения между константами.
Зависимость константы химического равновесия от температуры (изобара и изохора химической реакции).
Принцип Ле-Шателье.
Скорость химической реакции. Закон действующих масс. Константа скорости.
Молекулярность и порядок реакции.
Кинетическая классификация по степени сложности. Обратимые и необратимые реакции.
Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Арреннуса.
Энергия активации химической реакции. Аналитический и графический метод расчета.
Скорость гетерогенной химической реакции. Особенности ее протекания.
Инициирование химических реакций. Катализ. Сущность гомогенного и гетерогенного катализа.
Дисперсные системы. Коллоидные растворы.
Растворы (разбавленные, концентрированные, насыщенные, пересыщенные). Растворимость. Способы выражения концентраций растворов.
Физические и химические процессы при растворении. Растворимость твердых тел и жидкостей в жидкостях.
Растворимость газов в жидкостях. Закон Генри-Дальтона. Закон распределения.
Законы Рауля-Криоскония и эбуллиоскопия.
Электролитическая диссоциация. Степень диссоциации. Слабые электролиты. Константа диссоциации. Закон разведения Оствальда..
Сильные электролиты. Понятие активности и коэффициента активности.
Электролитическая диссоциация воды. Ионное произведение воды. Водородный показатель. Понятие об индикаторах.
Гидролиз солей. Константа и степень гидролиза.
Произведение растворимости. Условия выпадения осадка.
ОВР. Ионно-электронный метод подбора коэффициентов в ОВР.
Возникновение скачка потенциала на границе раздела «металл-раствор». Равновесный электродный потенциал.
Медно-цинковый гальванический элемент Якоби-Даниэля. Процессы на электродах. Понятие ЭДС.
Зависимость ЭДС гальванического элемента от природы реагирующих веществ, температуры и концентрации. Стандартная ЭДС.
Стандартный водородный электрод. Формула Нериста. Стандартный потенциал.Ряд напряжений. Расчет ЭДс гальванического элемента.
Типы электродов и цепей. Окислительно-восстановительные электроды и цепи.
Электролиз. Последовательность разряда ионов на катоде и аноде.
Законы Фарадея. Выход по току. Понятие химической и концентрационной поляризации при электролите. Перенапряжение.
Классификация химических источников тока.
Коррозия металлов. Химическая и электрохимическая коррозия.
Основные методы борьбы с коррозией.
Кристаллическое состояние вещества. Химическая связь в кристаллах.
Составные части системы и компоненты. Правило фаз. Диаграмма состояния однокомпонентной системы (на примере воды).
Сущность термографического анализа. Кривые нагревания и охлаждения. Принцип построения диаграммы плавкости бинарной системы.
Эвтектическая диаграмма плавкости (без образования твердых растворов).
Поверхностные явления. Понятие поверхностного натяжения.
Адсорбция и абсорбция. Изотермы адсорбции.
10. Связь периодич-го з. Со строением эл-ных оболочек атомов. Пр. Клечковского. Энергетич. Ячейки. Правило Хунда.
Д. Менделеев открыл закон в 1869 году, сформулировав его: «Св-ва простых тел, а также формы и св-ва соединений элементов находятся в периодической зависимости от величины атомных весов эл-ов.»В 1869 было известно всего 63 эл-та, в наст.вр.– 109.
Периодич.сист.– по сути изобр.периодич.закона.
Период – послед-ть атомов с одинаковым числом эл.слоев.Электроны заполняют при застройке оболочек наиболее выгодные в эн-м отношении подуровни.
1-ое правилу Клечковского, последовательное заполнение электрон.орбиталей происходит от орбиталей с меньшим знач.суммы n+1 к большим знач.этой суммы.
2-ое правило Клечковского: при одинаковом знач.суммы заполнение происх.в напр.увелич. «n».Порядок заполнения атомных орбиталей:
1s2-2s2-2p6-3s2-3p6-4s2-3d10-4p6-5s2-4d10-5p6-6s2-5d1-4f14-5d2-10-6p6-7s2-6d1-5f14-6d2-10-7p6.
Периодич.сист.полностью отражает прядок заполнения эл-ми эн.уровней атомов любых эл-ов.Правило Гунда: суммарный спин данного подуровня должен быть макс., т.е. электроны стремятся занять макс.число св.кв.сост..
8. Волновые свойства электрона. Квантовые числа,s-, p-,d-,f-состояния электронов. Электронные орбитали.
Атомные частицы обладают одновременно и корпускулярными, и волновыми св-ми.
Луи де Бройль p=mv длина волны h/mv h-постоянная Планка 6.6 *1034 Дж*с.
Волновые св-ва: дифракция и интерференция.
Корпускулярные св-ва: электрон действует как частица, как единое целое. Движ.–пульсирующее. Сост.любого электрона в атоме может быть охарактеризовано набором 4 квантовых чисел: n, l, m, s.Гл.кв.ч.характеризует общий уровень эн.эл-на. Принимает знач. от 1 до 7 (соотв.буквенным обозначениям: k,l,m,n,o,p,q).Эл-е уровни подразделяются на подуровни. Эл-ны одного и того же подуровня различны по величине момента кол-ва дв-я mvr ( r – радиус орбиты).Число подуровней=числу уровн(макс.ч.подуровней–4).Побочное (орбитальное)кв.число хар-ет энергетич.сост. электрона на подуровне (l=n-1).Магн.к.ч.опр. ориентацию эл-го облака в пространстве (+3,+2,+1,0, -1, -2, -3).Спиновое к.ч. характеризует напр.вр-я электрона. (+1/2 и -1/2). Наиб.ч. эл-ов на подуровне вычисл.по формуле 2n2.макс.число – 32. Распр.эл-ов по уровням и подуровням изобр. с помощью электронных формул или ячеек. Пример: Mg-1s22s22p63s2.
9. Принцип Паули. Емкость энергетических уровней и подуровней атомов элементов.
Принцип Паули: в атоме не может быть 2 электронов с одинаковым набором всех 4 к.ч.
У двух электронов могут быть попарно одинаковыми 3 числа, но они обязаны различаться по четвертому.
Наибольшее
число электронов Z
в оболочке с главным квантовым числом.
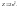
Максимальное число электронов на одном уровне известных ныне электронов – 32.
Ограничение принципа Паули: внешний электронный уровень атомов (кроме элемента №46 – палладий) может состоять максимум из двух подуровней – S и P.
То
есть максимально возможное число
электронов на внешнем уровне отвечает
конфигурации
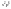 (8 электронов).
(8 электронов).
На s-2, на p(3орбиты)-6, на d(5орбит)-10, на f(7орбит)-14эл-ов.
