
- •10. Связь периодич-го з. Со строением эл-ных оболочек атомов. Пр. Клечковского. Энергетич. Ячейки. Правило Хунда.
- •8. Волновые свойства электрона. Квантовые числа,s-, p-,d-,f-состояния электронов. Электронные орбитали.
- •9. Принцип Паули. Емкость энергетических уровней и подуровней атомов элементов.
- •16.Ионная (электронная связь).
- •15.Направленность ковалентной связи ᵹ- и π-связи. Гибридизация атомных орбиталей.
- •19.Донорно-акцепторный механизм ков.Св.. Комплексные соединения.
- •17. Представление о методе молекулярных орбиталей.
- •14. Ков.(атомная) св.. Метод валентных связей. Возбужденные состояния атомов. Валентность.
- •13.Образование химической связи. Энергия и длина связи.
- •11. Периодич.З.Д.И.Менделеева и периодич.Сист. Эл-ов: ряды, периоды, группы, подгруппы, порядковый номер эл-та.
- •7. З.Хим.Экв-ов. Молярные экв-ные массы сложных в-в.
- •3. Понятие о химическом эквиваленте и эквивалентной массе простых и сложных веществ. Закон химических эквивалентов.
- •6. Основные стехиометрические законы.
- •5. Основные газовые законы. Определение молекулярных масс газообразных веществ.
- •21. Система. Фаза. Компонент. Параметры. Функции состояния: внутренняя энергия и энтальпия. Стандартные условия.
- •22. Первое начало термодинамики. Закон Гесса как следствие первого начала термодинамики. Термохимические расчеты.
- •27. Объединенная формула первого и второго начала термодинамики. Свободная энергия Гиббса и Гельмгольца.Первый закон.
- •29.Условия самопроизвольного протекания химических реакций.
- •34.Скорость химической реакции. Закон действующих масс. Константа скорости.
- •36. .Кинетическая классификация по степени сложности. Обратимые и необратимые реакции.
- •41. Дисперсные системы. Коллоидные растворы.
- •37 .Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса
- •44. Растворимость газов в жидкостях. Закон Генри-Дальтона. Закон распределения.
- •50.Произведение растворимости.
- •12. Периодическое изменение свойств химических элементов. Радиус атомов, сродство электрону,
- •57.Электролиз. Последовательность разряда ионов на катоде и аноде.
- •3) Ме,стоящие в ряду напр-я посла водорода
- •59.Классификация химических источников тока.
- •60. Коррозия металлов. Химическая и электрохимическая коррозия.
- •61. Основные методы борьбы с коррозией.
- •62. Кристаллическое состояние вещества. Химическая связь в кристаллах.
- •64.Сущн-ть физико-химич.Анализа.Пр-ло фаз.Диаграмма состояния воды.
- •67.Адсорбция и абсорбция.
- •64. Основные принципы построения диаграммы плавкости бинарных систем.
- •1. Принцип непрерывности.
- •2. Принцип соответствия.
- •65. Эвтектическая диаграмма плавкости (без образования твердых растворов).
22. Первое начало термодинамики. Закон Гесса как следствие первого начала термодинамики. Термохимические расчеты.
Существует множество формулировок первого закона:
В
изолированной
системе общий запас энергии сохраняется
постоянным.Поскольку
работа является одной из форм перехода
энергии, то, следовательно, невозможно
создание вечного двигателя первого
рода (машины, совершающей работу без
затраты энергии).Математическая
формулировка:
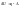 При
протекании изобарического
процесса:
При
протекании изобарического
процесса:
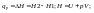
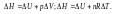
При протекании изохорического процесса:
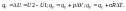
При протекании изотермического процесса:
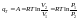
При протекании кругового процесса:
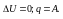
Термохимия – область физич.химии, занимающаяся изучением эн-х эффектов реакций.Если в уравнении указан ее энергетич-й эффект – это термохимическое ур-е.
V=const,
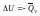
p=const,
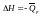
Русский ученый Гесс (1840) дал формулировку основному закону термохимии: тепловой эффект реакции, протекающей при постоянном объеме или при постоянном давлении, не зависит от пути реакции (от ее промежуточных стадий), а определяется только природой и состоянием исходных веществ и продуктов реакции.
Этот закон – прямое следствие первого закона термодинамики.
С помощью закона Гесса можно вычислять теплоты различных реакций, не проводя самих реакций.
Например:
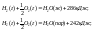
Вывод: теплота испарения одного моля воды равна 44 Дж.
25.Второе
начало термодинамики. Понятие об
энтропии. Расчет энтропии.Невозможен
самопроизвольный переход тепла от менее
нагретого тела более нагретому.Невозможно
создание вечного двигателя 2го рода(машины,
которая периодически превращает тепло
среды при пост.температуре в
работу.Термодинамич-й КПД:
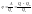 Для
изолир-ных систем критерием, позволяющим
судить о направлении процессов и об
условиях равновесия, является
функция-S-энтропия.Процессы
протекают в сторону увеличения энтропии.
При равновесии энтропия достигает
макс-ма. Обратное протекание процессов
не может быть самопроизв-м – требуется
затрата работы извне.Физ.смысл функ-и
состояния энтропии легче всего
проиллюстрировать на примере кипения
жидкости.При нагреве Т и U
увелич.до тех пор, пока жидкость не
закипит. При этом поглощается теплота
испарения, затрачиваемая на увеличение
беспорядка в системе.Таким образом,
энтропия – мера упорядоченности
состояния системы.
Для
изолир-ных систем критерием, позволяющим
судить о направлении процессов и об
условиях равновесия, является
функция-S-энтропия.Процессы
протекают в сторону увеличения энтропии.
При равновесии энтропия достигает
макс-ма. Обратное протекание процессов
не может быть самопроизв-м – требуется
затрата работы извне.Физ.смысл функ-и
состояния энтропии легче всего
проиллюстрировать на примере кипения
жидкости.При нагреве Т и U
увелич.до тех пор, пока жидкость не
закипит. При этом поглощается теплота
испарения, затрачиваемая на увеличение
беспорядка в системе.Таким образом,
энтропия – мера упорядоченности
состояния системы.
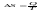 -2е
начало термодинамики для обратимых
процессов.В изолированной
системе процессы самопроизвольные
процессы протекают в сторону увелич-я
энтропии
-2е
начало термодинамики для обратимых
процессов.В изолированной
системе процессы самопроизвольные
процессы протекают в сторону увелич-я
энтропии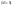 В
неизолированных–возможно
В
неизолированных–возможно
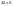 Примеры:
Примеры:
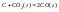
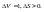
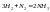
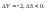
27. Объединенная формула первого и второго начала термодинамики. Свободная энергия Гиббса и Гельмгольца.Первый закон.
Теплота,
подведенная к системе, расходуется на
приращение внутренней энергии системы
и на работу системы над окружающей
средой.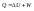 Второй
закон.Несколько
формулировок, выберем эту: в изолированных
системах самопроивзольно идут процессы,
которые сопровождаются возрастанием
энтропии:
Второй
закон.Несколько
формулировок, выберем эту: в изолированных
системах самопроивзольно идут процессы,
которые сопровождаются возрастанием
энтропии:
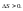 Энтропия
– термодинамическая функция,
характеризующая меру неупорядоченности
состояния системы. Она используется
для суждения о направлении самопроизвольно
протекающих процессах.Обобщенный
закон.Для
каждой изолированной термодинамической
системы существует состояние
термодинамического равновесия, которого
она при фиксированных внешних условиях
с течением времени самопроизвольно
достигает.Энергия
Гельмгольца.Максимальная
работа, которую может совершить система
при рановесном проведении процесса,
равна изменению энергии Гельмгольца
реакции
Энтропия
– термодинамическая функция,
характеризующая меру неупорядоченности
состояния системы. Она используется
для суждения о направлении самопроизвольно
протекающих процессах.Обобщенный
закон.Для
каждой изолированной термодинамической
системы существует состояние
термодинамического равновесия, которого
она при фиксированных внешних условиях
с течением времени самопроизвольно
достигает.Энергия
Гельмгольца.Максимальная
работа, которую может совершить система
при рановесном проведении процесса,
равна изменению энергии Гельмгольца
реакции
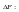
 Энергия
Гельмгольца равна
Энергия
Гельмгольца равна

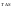 называют связанной
энергией.Она
характеризует предел самопроизвольного
течения реакции, которое возможно при
называют связанной
энергией.Она
характеризует предел самопроизвольного
течения реакции, которое возможно при
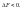 Энергия
Гиббса.Энтальпийный
и энтропийный факторы, характеризующие
процессы, объединены функцией - энергия
Гиббса.
Энергия
Гиббса.Энтальпийный
и энтропийный факторы, характеризующие
процессы, объединены функцией - энергия
Гиббса.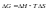 Поскольку энергию Гиббса можно превратить
в работу, то ее называют свободной
энергией.
Поскольку энергию Гиббса можно превратить
в работу, то ее называют свободной
энергией.
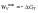 Химическая
реакция возможна, если энергия Гиббса
уменьшается (<0).Энергия Гиббса
образования вещества – изменение
энергии Гиббса системы при образовании
1 моль вещества В из простых веществ,
устойчивых при 298 К.
Химическая
реакция возможна, если энергия Гиббса
уменьшается (<0).Энергия Гиббса
образования вещества – изменение
энергии Гиббса системы при образовании
1 моль вещества В из простых веществ,
устойчивых при 298 К.
