
- •Введение
- •1. Основы молекулярно- кинетической теории (мкт).
- •1.1 Количественное выражение элементов системы.
- •1.2 Мкт газов.
- •1.3 Изопроцессы
- •1.4 Закон Авагадро.
- •1.5 Закон Дальтона.
- •1.6 Вероятный характер скорости хаотического движения.
- •1.7 Реальные газы
- •2 Термодинамика
- •2.1 Основные понятия и определения термодинамики.
- •2.2 Понятие о тд системах.
- •2.3 Законы начала термодинамики. Их использование.
- •2.4 Термохимия. Использование первого закона тд.
- •2.5 Закон Гесса.
- •2.6 Теплота образования
- •2.7. Теплота растворения
- •2.8 Теплота нейтрализации
- •2.9 Зависимость тепловых эффектов от температуры.
- •3 Второй закон термодинамики
- •3.1 Обратимые и необратимые процессы.
- •3.2 Характеристические функции тд систем.
- •3.3 Направление протекания процессов.
- •3.4 Химический потенциал
- •4.1 Закон действия масс. Константа равновесия.
- •4.2 Правило фаз
- •4.3 Общие представления о диаграммах состояния.
- •4.4 Однокомпонентные системы
- •4.5 Двухкомпонентные системы
- •4.6 Основные виды диаграмм состояния двухкомпонентных систем.
- •4.7 Термический анализ.
- •4.8 Фазовые переходы
- •5 Закон Рауля.
- •6 Физико-химические особенности процессов подготовки подложек при получении эс и микроэлектронных изделий
- •6.1 Поверхностные явления при изготовлении ис, эс
- •6.2. Технология очистки подложек для производства микроэлектронных изделий
- •6.2.1. Важность снижения уровня загрязнений
- •6.2.2. Классификация загрязнений
- •6.2.3. Источники загрязнений
- •6.3. Влияние загрязнений на характеристики микроэлектронных изделий
- •6.3.1. Механические загрязнения
- •6.3.2. Металлические загрязнения
- •6.3.3. Микронеровности поверхности
- •6.3.4. Кристаллические дефекты
- •6.4. Механические загрязнения на поверхности полупроводниковых пластин
- •6.4.1. Адгезия механических частиц на поверхность полупроводниковых пластин
- •6.4.2. Удаление загрязнений с поверхности пластин в процессах химической обработки
- •6.4.3. Очистка поверхности подложек в перекисно-аммиачном растворе
- •6.5. Методы исследования состояния и характеристик поверхности подложек
- •6.5.1. Методы анализа частиц на поверхности пластин
- •6.5.2. Методы анализа органических загрязнений на поверхности пластин
- •6.5.3. Методы анализа металлических загрязнений на поверхности пластин
- •6.5.4. Методы исследования рельефа поверхности подложек
- •6.6. Технологические процессы очистки поверхности полупроводниковых пластин
- •6.6.1. "Жидкостная" химическая обработка
- •6.6.2. Методы проведения "жидкостной" химической обработки
- •6.6.3. "Сухая" химическая обработка
- •6.7. Проблемы очистки поверхности полупроводниковых пластин
- •6.7.1. Влияние химической обработки на шероховатость поверхности Si пластин
- •6.7.2. Проблемы нежелательного формирования слоев оксида на поверхности кремниевых пластин
- •6.7.3. Органические загрязнения на поверхности полупроводниковых пластин
- •7. Физико-химические аспекты получения многослойных структур
- •7.1. Имплантация ионов водорода в кремниевые пластины
- •7.2. Особенности технологии прямого сращивания подложек
- •7.3. Сращивание пластин, покрытых SiO2
- •7.4. Состояние сращенных пластин
- •7.5. Плоскостность пластин
- •7.6. Утончение сращенных пластин
- •7.7. Микродефекты сращенных структур
- •7.8. Радиационные свойства многослойных структур
- •7.9. Движение и залечивание пор на границе сращивания стандартных пластин кремния
- •7.9.1. Скорость движения пор, связанных с диффузионными потоками в объеме матрицы, в поле температурного градиента
- •7.9.2. Скорость перемещения пор за счет диффузии атомов на ее поверхности в поле температурного градиента
- •7.9.3. Скорость перемещения пор за счет диффузии атомов в объеме в поле температурного градиента
- •7.9.4. Скорость движения пор в неоднородном поле напряжений при разных механизмах перемещения
- •7.9.5. Диффузионное движение пор вблизи границы кристалла, обусловленное поверхностной диффузией
- •7.9.6. Диффузионное движение пор под действием сил со стороны дислокаций
- •7.9.7. Рекристаллизация, спекание и залечивание пор
- •7.10. Пористый кремний в технологии прямого соединения
- •7.10.1. Теория и экспериментальные исследования заращивания пористых слоев
- •7.10.2 Осаждение слоев кремния на стенках пор и капилляров из парогазовых смесей
- •8. Исследование физико-химических свойств многослойных структур
- •8.1. Определение энергии связи прямого связывания пластин кремния методом генерации трещины между поверхностями сращивания
- •8.2. Исследование многослойных структур и материалов, используемых в процессе их производства эс, методами позитронной аннигиляционной спектроскопии
- •8.2.1. Сущность и особенности методов позитронной аннигиляционной спектроскопии
- •8.2.2. Теория метода ураф и результаты исследований
- •8.2.3. Определение концентрации электронов np в зоне проводимости металлов
- •8.2.4. Исследование полупроводников методом пас
- •8.3. Исследование поверхности пластин
- •8.3.1. Метод масс-спектрометрического исследования процесса термодесорбции с поверхности кремниевых пластин
- •8.3.2. Измерения контактной разности потенциалов подложек
- •8.3.3. Влияние адсорбции на электронные свойства поверхности твердых тел
- •Список литературы к главе 8
1.3 Изопроцессы
закон Бойля-Мариотта
T=const; p1/p2=V1/V2; pV=const (1.14)
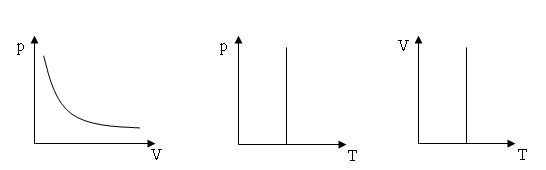
Зависимости называются изотермами.
закон Гей-Люссака
p=const; V1/V2=T1/T2; V/T=const (1.15)
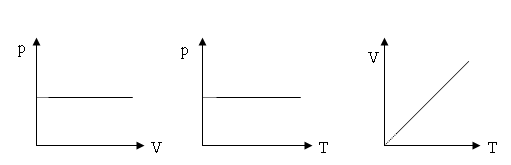
Зависимости называются изобарами.
закон Шарля
V=const; p1/p2=T1/T2; p/T=const (1.16)
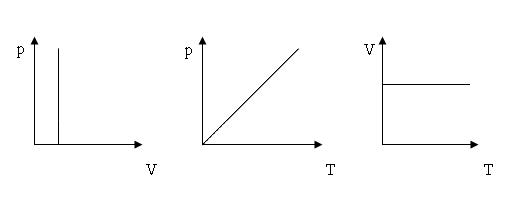
Зависимости называются изохорами.
При постоянной температуре объем данного количества газа обратно пропорционально давлению, при котором находиться газ. Зависимость p(V) близка к гиперболической. Следствие: т. к. чистота газа и концентрация их при T=const связаны с массой газа и его объемом, то они прямо пропорциональны давлению, при котором находится газ. Поэтому будет справедливо соотношение:
ρ1/ ρ2=p1/p2 ; n1/n2=p1/p2 (1.17);
где ρ – плотность газа и n –концентрация.
При постоянном давлении для данной массы газа объем идеального газа прямо пропорционален его абсолютной температуре. Иначе при постоянном давлении изменение T на 1 градус вызывает изменение данного газа на 1/273 его объема при температуре 0 0C. Если известны объем V0 при 0 0C, требуется узнать объем при T, то можно использовать выражение VT=V0T1/T0, где T1 - температура отличная от 0 К. Следствие: плотность и концентрация газа при давлении const обратно пропорциональны его абсолютной температуре, что выражается соотношением:
ρ 1/ ρ2=T2/T1 ; n1/n2= T2/T1. (1.18)
Кроме того, из этого закона вытекает, что давление данной массы газа при постоянном объеме прямо пропорционально повышению температуры, что можно выразить соотношением:
ρ = ρ0(1+ αρT) (1.19),
где ρ0 – давление газа при 0 0C, а αρ – коэффициент объемного расширения.
для данной массы газа при постоянном объеме давление газа прямо пропорционально его абсолютной температуре.
1.4 Закон Авагадро.
Основной газовый закон, который гласит в равных объемах разных газов при одинаковых температурах и давлении содержится одинаковое количество молекул. При нормальных условиях T=0 0C и давлении 760 мм рт. ст. один моль газа занимает объем равный 22,4 м3 и содержит 6,02*1023 молекул. В одном м3 любого газа одинаковое количество молекул равное 2,69*1025 м3 и называется числом Ломмидта (NL). Если одновременно изменять температуру и давление, то взаимосвязь между ними и объемом газа определится уравнением Клапейрона – Менделеева для одного моля, для n молей PVn=nRT (1.20).
1.5 Закон Дальтона.
В обычных условиях различные газы не вступающие в химические реакции обладают способностью смешиваться в любых количествах. Закон Дальтона выражает зависимость между общим давлением смеси газов и порциальным давлением ее составляющих. Следует читать: общее давление смеси газов находящихся в определенном объеме равно сумме тех порциальных давлений, которыми обладал бы каждый отдельно взятый газ, если бы он один занимал тот же объем, который занимает вся смесь, и находился бы при одной и той же температуре. Математически общее давление смеси равняется
pсм=p1+p2+...+pn (1.21)
где pсм – давление смеси, pn – порциальное давление газов входящих в смесь.
