
- •Введение
- •1. Основы молекулярно- кинетической теории (мкт).
- •1.1 Количественное выражение элементов системы.
- •1.2 Мкт газов.
- •1.3 Изопроцессы
- •1.4 Закон Авагадро.
- •1.5 Закон Дальтона.
- •1.6 Вероятный характер скорости хаотического движения.
- •1.7 Реальные газы
- •2 Термодинамика
- •2.1 Основные понятия и определения термодинамики.
- •2.2 Понятие о тд системах.
- •2.3 Законы начала термодинамики. Их использование.
- •2.4 Термохимия. Использование первого закона тд.
- •2.5 Закон Гесса.
- •2.6 Теплота образования
- •2.7. Теплота растворения
- •2.8 Теплота нейтрализации
- •2.9 Зависимость тепловых эффектов от температуры.
- •3 Второй закон термодинамики
- •3.1 Обратимые и необратимые процессы.
- •3.2 Характеристические функции тд систем.
- •3.3 Направление протекания процессов.
- •3.4 Химический потенциал
- •4.1 Закон действия масс. Константа равновесия.
- •4.2 Правило фаз
- •4.3 Общие представления о диаграммах состояния.
- •4.4 Однокомпонентные системы
- •4.5 Двухкомпонентные системы
- •4.6 Основные виды диаграмм состояния двухкомпонентных систем.
- •4.7 Термический анализ.
- •4.8 Фазовые переходы
- •5 Закон Рауля.
- •6 Физико-химические особенности процессов подготовки подложек при получении эс и микроэлектронных изделий
- •6.1 Поверхностные явления при изготовлении ис, эс
- •6.2. Технология очистки подложек для производства микроэлектронных изделий
- •6.2.1. Важность снижения уровня загрязнений
- •6.2.2. Классификация загрязнений
- •6.2.3. Источники загрязнений
- •6.3. Влияние загрязнений на характеристики микроэлектронных изделий
- •6.3.1. Механические загрязнения
- •6.3.2. Металлические загрязнения
- •6.3.3. Микронеровности поверхности
- •6.3.4. Кристаллические дефекты
- •6.4. Механические загрязнения на поверхности полупроводниковых пластин
- •6.4.1. Адгезия механических частиц на поверхность полупроводниковых пластин
- •6.4.2. Удаление загрязнений с поверхности пластин в процессах химической обработки
- •6.4.3. Очистка поверхности подложек в перекисно-аммиачном растворе
- •6.5. Методы исследования состояния и характеристик поверхности подложек
- •6.5.1. Методы анализа частиц на поверхности пластин
- •6.5.2. Методы анализа органических загрязнений на поверхности пластин
- •6.5.3. Методы анализа металлических загрязнений на поверхности пластин
- •6.5.4. Методы исследования рельефа поверхности подложек
- •6.6. Технологические процессы очистки поверхности полупроводниковых пластин
- •6.6.1. "Жидкостная" химическая обработка
- •6.6.2. Методы проведения "жидкостной" химической обработки
- •6.6.3. "Сухая" химическая обработка
- •6.7. Проблемы очистки поверхности полупроводниковых пластин
- •6.7.1. Влияние химической обработки на шероховатость поверхности Si пластин
- •6.7.2. Проблемы нежелательного формирования слоев оксида на поверхности кремниевых пластин
- •6.7.3. Органические загрязнения на поверхности полупроводниковых пластин
- •7. Физико-химические аспекты получения многослойных структур
- •7.1. Имплантация ионов водорода в кремниевые пластины
- •7.2. Особенности технологии прямого сращивания подложек
- •7.3. Сращивание пластин, покрытых SiO2
- •7.4. Состояние сращенных пластин
- •7.5. Плоскостность пластин
- •7.6. Утончение сращенных пластин
- •7.7. Микродефекты сращенных структур
- •7.8. Радиационные свойства многослойных структур
- •7.9. Движение и залечивание пор на границе сращивания стандартных пластин кремния
- •7.9.1. Скорость движения пор, связанных с диффузионными потоками в объеме матрицы, в поле температурного градиента
- •7.9.2. Скорость перемещения пор за счет диффузии атомов на ее поверхности в поле температурного градиента
- •7.9.3. Скорость перемещения пор за счет диффузии атомов в объеме в поле температурного градиента
- •7.9.4. Скорость движения пор в неоднородном поле напряжений при разных механизмах перемещения
- •7.9.5. Диффузионное движение пор вблизи границы кристалла, обусловленное поверхностной диффузией
- •7.9.6. Диффузионное движение пор под действием сил со стороны дислокаций
- •7.9.7. Рекристаллизация, спекание и залечивание пор
- •7.10. Пористый кремний в технологии прямого соединения
- •7.10.1. Теория и экспериментальные исследования заращивания пористых слоев
- •7.10.2 Осаждение слоев кремния на стенках пор и капилляров из парогазовых смесей
- •8. Исследование физико-химических свойств многослойных структур
- •8.1. Определение энергии связи прямого связывания пластин кремния методом генерации трещины между поверхностями сращивания
- •8.2. Исследование многослойных структур и материалов, используемых в процессе их производства эс, методами позитронной аннигиляционной спектроскопии
- •8.2.1. Сущность и особенности методов позитронной аннигиляционной спектроскопии
- •8.2.2. Теория метода ураф и результаты исследований
- •8.2.3. Определение концентрации электронов np в зоне проводимости металлов
- •8.2.4. Исследование полупроводников методом пас
- •8.3. Исследование поверхности пластин
- •8.3.1. Метод масс-спектрометрического исследования процесса термодесорбции с поверхности кремниевых пластин
- •8.3.2. Измерения контактной разности потенциалов подложек
- •8.3.3. Влияние адсорбции на электронные свойства поверхности твердых тел
- •Список литературы к главе 8
4.3 Общие представления о диаграммах состояния.
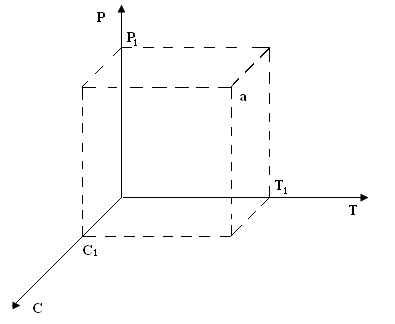
Рис. 4.2. Фигуративная точка в трехмерной системе координат
Если состояние системы описывается уравнением φ (Р,С, T) = 0, то численные значения этих параметров системы для каждого случая определяют положение некоторой точки в трехмерной системе координат:
Каждая точка характеризует определенное состояние системы, т. а соответствует состоянию системы при параметрах (Т1, С1, Р1). Эту точку называют фигуративной точкой данной системы, однако на практике нет необходимости всякий раз использовать трехмерное пространство, достаточно определить только два параметра, а третий можно определить из уравнения состояния системы. Таким образом для однозначного определения состояния системы достаточно определить положение фигуративной точки в двухмерной системе координат. Такое графическое изображение уравнения состояния системы называется диаграммой состояния. Математическое выражение уравнения состояния в большинстве случаев приводит к громоздким формулам и редко оправдывается в реальных системах. Таким образом, диаграммы состояния можно найти в справочниках, так как они являются результатами экспериментов и имеют огромную практическую значимость. С их помощью получают возможность наглядно изобразить в виде геометрических образов действительное взаимное положение физико-химических параметров, определяющих состояние системы.
4.4 Однокомпонентные системы
Примером может служить простое вещество и химическое соединение, обладающее строго определенным составом во всех агрегатных состояниях. Важно, чтобы систему составлял определенный химический индивидуум. Постоим диаграмму состояний Н2О в области невысоких давлений.
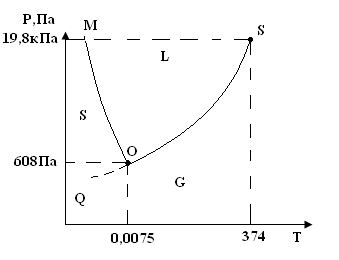
Рис. 4.3. Диаграмма состояния воды
Кривая OQ, OM, ON делит диаграмму состояния (ДС) в координатах (Р, Т) на при поля, представляющих собой совокупность точек, каждая из которых обозначает определенное агрегатное состояние. Поле S (solid) соответствует твердому состоянию; L (liquid) соответствует жидкому состоянию; G (gas) – газообразное состояние. Все точки, принадлежащие тому или иному полю отвечают однофазному состоянию и по правилу фаз обладают двумя степенями свободы:
F = k – y + 2 = 1 – 1 +2 = 2,
т.е. система бивариантна в пределах области. Это означает, что одновременное изменение Р и Т в пределах поля не вызывает появления других фаз.
Линия ON – граница, соответствующая состоянию равновесия между жидкостью и паром: LG; так как в равновесии находится две фазы, то F = 1 – 2 + 2 =1. Т.е. система моновариантна. Это означает, что не нарушая фазового равновесия на линии ON произвольно можно менять только один параметр. Для того, чтобы произвольное повышение температуры не вызывало исчезновение жидкости, необходимо на определенную величину повысить и давление, а если понизить давление, то для сохранения фазового равновесия надо понизить и температуру. Таким образом линия ON выражает зависимость давления насыщенных паров от Т. Также зависимость температуры кипения от внешнего давления. Следовательно, ON – кривая испарения. В точке N при температуре больше 374оС ни какое давление не может перевести в пар в жидкость. Эта точка называется критической точной кипения, а параметры, соответствующие ей называются критическими параметрами.
Линия ОМ – совокупность точек, соответствующих двухфазному равновесию между твердым и жидким состоянием. SL; и как всякое другое двухфазное равновесие однокомпонентной системы, обладает одной степенью свободы. Линия ОМ называется кривой плавления, так как она изображает зависимость Т от Р. Повышение давления перемещает температуру плавления в сторону меньших температур. Это связано с аномальным поведением воды. Ее плотность в твердом состоянии меньше плотности в жидком состоянии, а обычно кривые плавления описываются увеличением температуры плавления с повышением внешнего давления.
В большинстве случаев кривая плавления занимает почти вертикальное положение (давление влияет на температуру плавления не так заметно как на температуру кипения).
Кривая OM экспериментально получена до высоких давлений но критическая точка не обнаружена.
Линия OQ называется кривой сублимации (разгонки). Точки ее соответствуют равновесию между твердой и газообразной фазами. Это равновесие обладает одной степенью свободы (можно менять только 1 параметр Р или Т). Эта линия характеризует зависимость давления над твердым веществом от температуры и показывает влияние внешнего давления на Т сублимации (влияние заметное). Зависимость Т сублимации от низких давлений не изучается, но теоретически предполагается, что своим она имеет точку абсолютного нуля.
Линии ON, OM и OQ имеют общую точку О – называемую тройной точкой. Она соответствует состоянию системы, в которой пар – жидкость - твердое вещество находятся в равновесии по правилу фаз:
F = k – y + 2 = 1 – 3 + 2 = 0.
Это означает, что существование трех фаз в равновесии может продолжаться как угодно долго, но только при строго контролируемых единственных значениях параметров (Т = 0,0075оС, Р = 4,6 мм рт. ст.), (1 мм рт. ст. = 136 Па).
Линия ON1 - продолжение кривой кипения. Она изображает зависимость давления насыщенного пара над переохлажденной жидкостью. Ниже температуры тройной точки, жидкость является метастабильной (мета – примерно); т.е. условно стабильной фазой. Поэтому давление пара над ней выше, чем над твердой фазой стабильной при этих температурах.
Большинство диаграмм состояний однокомпонентных систем, в том числе и вода, оказываются более сложными в области высоких давлений. Причиной является полиморфизм, присущий многим веществам. Явление полиморфизма (многоформность) (как и слово аллотропия тоже обозначает другая форма) химических элементов химических соединений связаны со способностью вещества иметь разное строение (в кристаллических модификациях). Кристаллические модификации (КМ) различаются по своим физическим свойствам, несмотря на тождественность часто химических свойств из-за разного расположения частиц вещества. Примеры (S – имеют ромбическую и , С – алмаз – кубическая решетка, графит – гексагональная решетка). Однако существование обеих модификаций не равновероятно. Вероятность образования определенной решетки во многом связана с условиями образования. (Обычно с условиями охлаждения расплавов). А также с условиями, в которых данное вещество существует как открытая система.
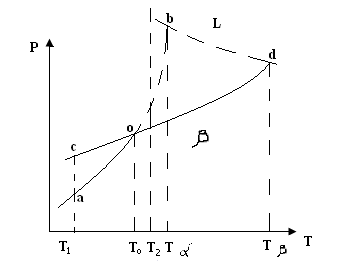
Рис. 4.4. Пример перехода вещества из одной модификации в другую
Предположив наличие модификаций α и β у некоторого вещества А, посмотрим его диаграмму состояния.
Кривая ab описывает изменение давления насыщенного пара α модификации от Т. (Кривая равновесия между твердым и парообразным состоянием). Пар твердое тело. Cd – тоже для β модификации. При Т1 давление Рβ больше чем Рα. Т.е. β менее устойчивая. Следовательно происходит переход из β -> α при Т1. Переход представляется как испарение β модификации и конденсации пара на частицах α модификации. По мере возрастания температуры разница в давлениях уменьшается и при То равна нулю. Следовательно, в т. О осуществляется переход α в β и наоборот (α β). Для дальнейшего увеличения температуры, давление Рα > Рβ => неустойчивой является α модификация при Т2>То. Таким образом в твердом состоянии при Т< То, существует α модификация. При Т>То существует β модификация.
Кривая bd изображает зависимость давления пара над жидкостью, поэтому в точке b -> Тпл α в точке d -> Тпл β. Вещества, имеющие на диаграмме состояния точки перехода из одной модификации в другую, называют энантиотронными (эн – при, антио – покрывать. Но для многих веществ не существует Т и Р, при которых наблюдаются переходы из одной кристаллической модификации в другую С, Р, СаСО3.
