
- •Введение
- •1. Основы молекулярно- кинетической теории (мкт).
- •1.1 Количественное выражение элементов системы.
- •1.2 Мкт газов.
- •1.3 Изопроцессы
- •1.4 Закон Авагадро.
- •1.5 Закон Дальтона.
- •1.6 Вероятный характер скорости хаотического движения.
- •1.7 Реальные газы
- •2 Термодинамика
- •2.1 Основные понятия и определения термодинамики.
- •2.2 Понятие о тд системах.
- •2.3 Законы начала термодинамики. Их использование.
- •2.4 Термохимия. Использование первого закона тд.
- •2.5 Закон Гесса.
- •2.6 Теплота образования
- •2.7. Теплота растворения
- •2.8 Теплота нейтрализации
- •2.9 Зависимость тепловых эффектов от температуры.
- •3 Второй закон термодинамики
- •3.1 Обратимые и необратимые процессы.
- •3.2 Характеристические функции тд систем.
- •3.3 Направление протекания процессов.
- •3.4 Химический потенциал
- •4.1 Закон действия масс. Константа равновесия.
- •4.2 Правило фаз
- •4.3 Общие представления о диаграммах состояния.
- •4.4 Однокомпонентные системы
- •4.5 Двухкомпонентные системы
- •4.6 Основные виды диаграмм состояния двухкомпонентных систем.
- •4.7 Термический анализ.
- •4.8 Фазовые переходы
- •5 Закон Рауля.
- •6 Физико-химические особенности процессов подготовки подложек при получении эс и микроэлектронных изделий
- •6.1 Поверхностные явления при изготовлении ис, эс
- •6.2. Технология очистки подложек для производства микроэлектронных изделий
- •6.2.1. Важность снижения уровня загрязнений
- •6.2.2. Классификация загрязнений
- •6.2.3. Источники загрязнений
- •6.3. Влияние загрязнений на характеристики микроэлектронных изделий
- •6.3.1. Механические загрязнения
- •6.3.2. Металлические загрязнения
- •6.3.3. Микронеровности поверхности
- •6.3.4. Кристаллические дефекты
- •6.4. Механические загрязнения на поверхности полупроводниковых пластин
- •6.4.1. Адгезия механических частиц на поверхность полупроводниковых пластин
- •6.4.2. Удаление загрязнений с поверхности пластин в процессах химической обработки
- •6.4.3. Очистка поверхности подложек в перекисно-аммиачном растворе
- •6.5. Методы исследования состояния и характеристик поверхности подложек
- •6.5.1. Методы анализа частиц на поверхности пластин
- •6.5.2. Методы анализа органических загрязнений на поверхности пластин
- •6.5.3. Методы анализа металлических загрязнений на поверхности пластин
- •6.5.4. Методы исследования рельефа поверхности подложек
- •6.6. Технологические процессы очистки поверхности полупроводниковых пластин
- •6.6.1. "Жидкостная" химическая обработка
- •6.6.2. Методы проведения "жидкостной" химической обработки
- •6.6.3. "Сухая" химическая обработка
- •6.7. Проблемы очистки поверхности полупроводниковых пластин
- •6.7.1. Влияние химической обработки на шероховатость поверхности Si пластин
- •6.7.2. Проблемы нежелательного формирования слоев оксида на поверхности кремниевых пластин
- •6.7.3. Органические загрязнения на поверхности полупроводниковых пластин
- •7. Физико-химические аспекты получения многослойных структур
- •7.1. Имплантация ионов водорода в кремниевые пластины
- •7.2. Особенности технологии прямого сращивания подложек
- •7.3. Сращивание пластин, покрытых SiO2
- •7.4. Состояние сращенных пластин
- •7.5. Плоскостность пластин
- •7.6. Утончение сращенных пластин
- •7.7. Микродефекты сращенных структур
- •7.8. Радиационные свойства многослойных структур
- •7.9. Движение и залечивание пор на границе сращивания стандартных пластин кремния
- •7.9.1. Скорость движения пор, связанных с диффузионными потоками в объеме матрицы, в поле температурного градиента
- •7.9.2. Скорость перемещения пор за счет диффузии атомов на ее поверхности в поле температурного градиента
- •7.9.3. Скорость перемещения пор за счет диффузии атомов в объеме в поле температурного градиента
- •7.9.4. Скорость движения пор в неоднородном поле напряжений при разных механизмах перемещения
- •7.9.5. Диффузионное движение пор вблизи границы кристалла, обусловленное поверхностной диффузией
- •7.9.6. Диффузионное движение пор под действием сил со стороны дислокаций
- •7.9.7. Рекристаллизация, спекание и залечивание пор
- •7.10. Пористый кремний в технологии прямого соединения
- •7.10.1. Теория и экспериментальные исследования заращивания пористых слоев
- •7.10.2 Осаждение слоев кремния на стенках пор и капилляров из парогазовых смесей
- •8. Исследование физико-химических свойств многослойных структур
- •8.1. Определение энергии связи прямого связывания пластин кремния методом генерации трещины между поверхностями сращивания
- •8.2. Исследование многослойных структур и материалов, используемых в процессе их производства эс, методами позитронной аннигиляционной спектроскопии
- •8.2.1. Сущность и особенности методов позитронной аннигиляционной спектроскопии
- •8.2.2. Теория метода ураф и результаты исследований
- •8.2.3. Определение концентрации электронов np в зоне проводимости металлов
- •8.2.4. Исследование полупроводников методом пас
- •8.3. Исследование поверхности пластин
- •8.3.1. Метод масс-спектрометрического исследования процесса термодесорбции с поверхности кремниевых пластин
- •8.3.2. Измерения контактной разности потенциалов подложек
- •8.3.3. Влияние адсорбции на электронные свойства поверхности твердых тел
- •Список литературы к главе 8
4.5 Двухкомпонентные системы
Состав систем: два компонента, которые могут быть как простейшими элементами, так и химическими соединениями. Химическое соединение является однокомпонентной системой. Соотношение между ними способно значительно изменять свойства систем. Это значит, что для однозначного определения состояния системы, нам надо знать параметры: Т, Р, С1, С2. Тогда уравнение состояния примет вид:
φ (Т, P, С1, С2) = 0 (4.16)
Следовательно, диаграмма состояния может быть построена в координатах Т, Р, С; четвертый параметр определяемся из уравнения состояния. При изучении Т плавления, Т фазовых переходов, большинство металлических систем в производственных условиях существуют при постоянном давлении. Следовательно, можно построить диаграмму состояния в координатах Т, С. Ось абсцисс (х) в этом случае, представляющую ось концентрации, изображают в виде отрезка, длину которого принимают за 100%. Концы этого отрезка будут соответствовать чистым компонентам, т.е. с одной стороны 100% компонента А, с другой стороны 100% компонента В. Любая точка, помещенная на отрезке делит его на части, характеризующие химических состав сплава. Для удобства: для точки С1 показано, что в сплаве содержится 60% - ВС1 и 40% АС1. Обычно на ось концентраций наносят только состав одного из компонентов.
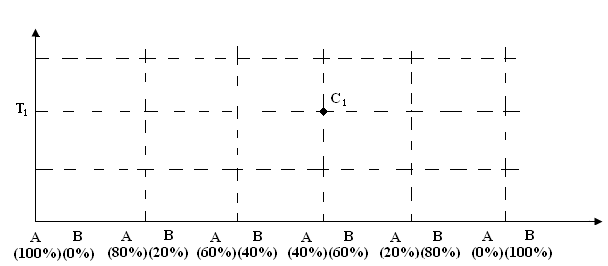
Рис. 4.5. Построение диаграммы состояния в координатах Т-С
Ось концентраций может быть отградуирована по массе. На оси ординат всегда откладывается температура (фактор интенсивности). Любая точка на диаграмме состояния (ДС) показывает, что сплав состава С1 находится при Т1, однако на ДС наносят Т плавления, затвердевания, фазовые переходы и других характерных процессов. Линии, соединяющие эти точки называются:
Линия, представляющая совокупность точек начала кристаллизации называется ликвидус. Выше ликвидуса сплавы находятся в однофазном жидком состоянии. Линия, ниже которой сплав находится полностью в твердом состоянии называется солидус (линия конца кристаллизации).
Для проверки правильности диаграммы состояния используют правило фаз. Правило фаз позволяет предсказать, что в двухкомпонентных системах максимальное число равновесно существующих фаз рвано 3, так как из двух переменных выбираем одну Т, давление Р=const. А вариантность системы не может быть меньше 0. Следовательно, y = k – F + 2 = 2 – 0 + 1 – 3.
Трехфазное равновесие безвариантно в двухкомпонентных системах. Так как газообразная фаза нас не интересует, рассмотрим жидкое и твердое состояния. Равновесие двух фаз в двухкомпонентных системах одновариантно. Однофазное равновесие такой системы двухвариантно. Это означает, что давление, которое условно принимаем за неизменное, тоже может быть изменено без нарушения фазового равновесия.
4.6 Основные виды диаграмм состояния двухкомпонентных систем.
Первый тип является самым простейшим и применяется для жидких смесей. Отражает систему, в которой взаимная растворимость компонентов А и В в жидком и твердом состояниях отсутствуют. Тогда ДС следующая:
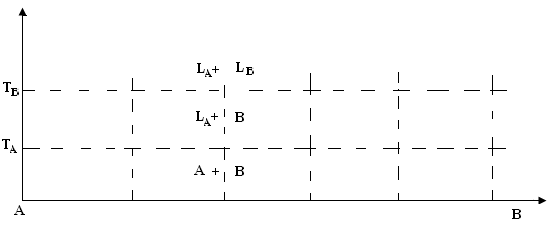
Рис. 4.6. ДС для системы, в которой взаимная растворимость компонентов А и В в жидком и твердом состояниях отсутствуют
ТА и ТВ – температуры плавления, А и В концентрации веществ. Выше температуры ТВ система состоит из двух жидких фаз αА и αВ. Между ТА и ТВ начинают выпадать кристаллы В, а вещество А находится в жидком состоянии, то есть этот промежуток - двухфазный. Ниже ТА из смеси кристаллов А и В образуется твердый сплав.
Тип два диаграмма состояний: с простой эвтектикой (греч. легкоплавящийся).
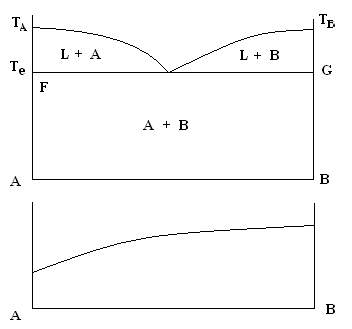
Рис. 4.7. ДС для системы, в которой взаимная растворимость А и В в жидком состоянии не ограничена, а в твердом состоянии отсутствует
Если взаимная растворимость А и В в жидком состоянии не ограничена, а в твердом состоянии отсутствует, то при затвердевании сплав представляет собой смесь кристаллов чистых компонентов А и В. Такая система характеризуется диаграммой состояний с простой эвтектикой. Эвтектика – это тонкая мелко дисперсная смесь твердых веществ, одновременно выкристаллизовывающихся из расплава, при температуре плавления меньше, чем температура плавления отдельных компонентов. На диаграмме состояний можно видеть области. Область, выше ТА, Те, ТВ является жидкостью однофазной областью однородного расплава. Линия ТАеТВ над линией ликвидуса. Выше ее однофазная, ниже двухфазная. Область FTΔе представляет собой двухфазную систему жидкость плюс кристаллы А. Область GTΔе также двухфазная область жидкость и кристаллы В. Область AFGB – двухфазная область, где имеются твердые вещества в смеси. Эвтектика не является самостоятельной фазой, а лишь дисперсной смесью двух фаз А и В.
Из жидкости, состав которой лежит между А и е, при охлаждении начитают выпадать кристаллы А в следствии чего содержание В в жидкости увеличивается. А когда состав будет отвечать е, процесс закончится кристаллизацией эвтектики. Затвердевание жидкости, состав которой лежит между В и е начинается выпадение кристаллов В и заканчивается кристаллизацией эвтектики.
Линия FG называется линией солидуса, ниже нее жидкая фаза отсутствует полностью. Изотерма свойств такого сплава приближается к прямой линии.
Третий тип диаграммы состояния. Компоненты А и В обладают неограниченной взаиморастворимостью в жидком и твердом состоянии. Тогда из одной жидкой фазы F выпадает только одна кристаллическая фаза – твердый раствор S.
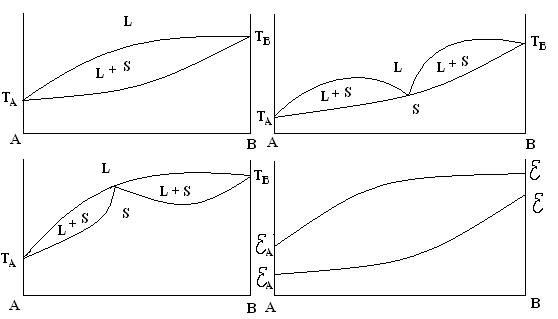
Рис. 4.8. ДС для системы, в которой компоненты А и В обладают неограниченной взаиморастворимостью в жидком и твердом состоянии
Диаграмма состояния такой системы может быть без max и min (а). Либо с max и min (б, в). Изотерма свойств имеет вид непрерывных кривых, обращенных выпуклостью вверх или вниз в зависимости от вида ДС. Твердые растворы представляют собой непрерывный ряд твердых фаз, т.е. это твердая фаза переменного состава, в которой атомы различных элементов смешаны в известных пределах или неограниченно в общую кристаллическую решетку.
твердый раствор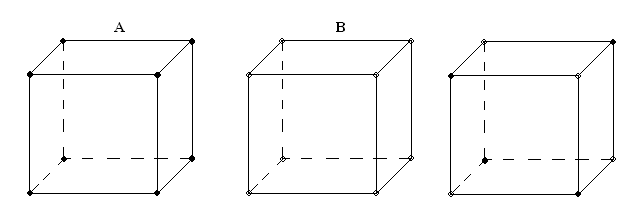
Рис. 4.9. Схематичное изображение кристаллической решетки твердого раствора
Полностью упорядоченные твердые растворы называют сверхструктурами. Примеры: Сu-Ni; Fe-N; Fe-Cr; Fe-Co; Ni-Co; Au-Ag; Si-Ge; Au-Cu; Bi-Sb.
Способностью образовывать твердые растворы в любых пропорциях могут обладать только элементы, имеющие одинаковый тип кристаллической решетки; в этом случае говорят о неограниченной растворимости. Признаки: находятся рядом
По механизму образования их различают:
- твердые растворы замещения – близкие атомные радиусы, отличающиеся не более чем на 15% и электрохимически подобны, т.е. в ряду напряжений стоят не далеко друг от друга;
- твердые растворы внедрения – у них атомные радиусы существенно отличаются, однако внедрение возможно в междоузлие т.е. атом удерживается, в промежутке;
- твердые растворы вычитания, которые образованы вакантными узлами кристаллической решетки.
Таким образом, для получения твердого раствора нужны два фактора: размерный и электрохимическое подобие. В отличие от твердых растворов химические соединения образуются только при единственных составах. Химические соединения происходят когда элементы резко отличаются друг от друга по:
- электронному строению;
- атомному объему;
- типу и параметрам кристаллических решеток, которые определяют реакционную способность материала.
Реакционная способность веществ в современных представлениях основана на электронной теории валентности и квантово механической теории. Т.е. распределение и смещение электронной плотности. Таким образом, даже если в жидком состоянии два металла хорошо растворяются друг в друге, т.е. образуют однородный жидкий раствор, то в твердом состоянии структура может оказаться разной. Если в процессе кристаллизации разнородные атомы не входят в общую решетку, а каждый металл образует свою решетку, то это соответствует полной нерастворимости их в твердом состоянии. Т.е. кристаллы компонентов, входящих в сплав, образуют простую смесь. Если образуется общая кристаллическая решетка, то получается твердый раствор. Кроме большого диапазона концентраций веществ твердые растворы отличаются от химических соединений еще и непрерывностью свойств. Если при переходе в твердое состояние разнородные атомы могут соединяться друг с другом в определенной пропорции с протеканием химических реакций, то образуются новые вещества, называемые химическими соединениями.
Растворимость в жидком состоянии зависит от атомного сплавления элементов и Тпл, при этом существенный вклад в кинетику процессов образования жидких растворов вносит процесс диффузии, т.е. взаимопроникновение. Растворимость в твердом состоянии зависит от размерных эффектов (тип решетки, ее параметры) и физико-химической природы растворимых веществ.
Четвертый тип ДС. Если взаимная растворимость веществ А и В в жидком состоянии неограниченна, а в твердом ограничена, то в случае образования эвтектики, последняя состоит из смеси двух твердых растворов α и β. Предельные концентрации которых отвечают точкам G и F на ДС. Таких сплавов большинство это и Al-Si; Jn-Si; Zn-Si; Sn-Sb.


Рис. 4.10. ДС для системы, в которой взаимная растворимость веществ А и В в жидком состоянии неограниченна, а в твердом ограничена,
При эвтектической температуре свойствам отвечают точки G и F. При комнатной – точки M и N. Изотермы свойств состав состоят из трех ветвей при комнатной температуре. В т. m1 и m2 и n1 и n2 отвечают предельным концентрациям твердых растворов α и β, соответствующим комнатной температуре.
Тип пять ДС. Если в процессе сплавления двух металлов или компонентов образуются химические соединения С, плавящиеся без разложения, то на кривой ликвидуса наблюдаются либо max (M), либо т. D, отвечающая составу соединения С и две эвтектические точки E1 и Е2, отвечающие эвтектикам, образуемым С с А и В.
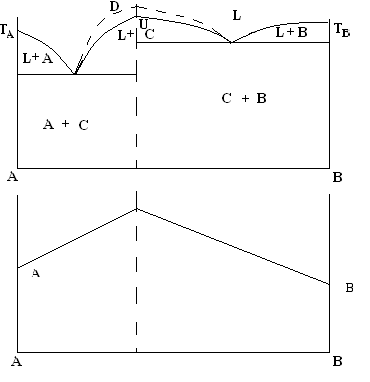
Рис.4.11. ДС для системы, в которой при сплавлении двух или компонентов образуются химические соединения С, плавящиеся без разложения
Таким образом, данная ДС по сути состоит из двух ДС с простой эвтектикой, что характерно Si-Me.
