
- •Введение
- •1. Основы молекулярно- кинетической теории (мкт).
- •1.1 Количественное выражение элементов системы.
- •1.2 Мкт газов.
- •1.3 Изопроцессы
- •1.4 Закон Авагадро.
- •1.5 Закон Дальтона.
- •1.6 Вероятный характер скорости хаотического движения.
- •1.7 Реальные газы
- •2 Термодинамика
- •2.1 Основные понятия и определения термодинамики.
- •2.2 Понятие о тд системах.
- •2.3 Законы начала термодинамики. Их использование.
- •2.4 Термохимия. Использование первого закона тд.
- •2.5 Закон Гесса.
- •2.6 Теплота образования
- •2.7. Теплота растворения
- •2.8 Теплота нейтрализации
- •2.9 Зависимость тепловых эффектов от температуры.
- •3 Второй закон термодинамики
- •3.1 Обратимые и необратимые процессы.
- •3.2 Характеристические функции тд систем.
- •3.3 Направление протекания процессов.
- •3.4 Химический потенциал
- •4.1 Закон действия масс. Константа равновесия.
- •4.2 Правило фаз
- •4.3 Общие представления о диаграммах состояния.
- •4.4 Однокомпонентные системы
- •4.5 Двухкомпонентные системы
- •4.6 Основные виды диаграмм состояния двухкомпонентных систем.
- •4.7 Термический анализ.
- •4.8 Фазовые переходы
- •5 Закон Рауля.
- •6 Физико-химические особенности процессов подготовки подложек при получении эс и микроэлектронных изделий
- •6.1 Поверхностные явления при изготовлении ис, эс
- •6.2. Технология очистки подложек для производства микроэлектронных изделий
- •6.2.1. Важность снижения уровня загрязнений
- •6.2.2. Классификация загрязнений
- •6.2.3. Источники загрязнений
- •6.3. Влияние загрязнений на характеристики микроэлектронных изделий
- •6.3.1. Механические загрязнения
- •6.3.2. Металлические загрязнения
- •6.3.3. Микронеровности поверхности
- •6.3.4. Кристаллические дефекты
- •6.4. Механические загрязнения на поверхности полупроводниковых пластин
- •6.4.1. Адгезия механических частиц на поверхность полупроводниковых пластин
- •6.4.2. Удаление загрязнений с поверхности пластин в процессах химической обработки
- •6.4.3. Очистка поверхности подложек в перекисно-аммиачном растворе
- •6.5. Методы исследования состояния и характеристик поверхности подложек
- •6.5.1. Методы анализа частиц на поверхности пластин
- •6.5.2. Методы анализа органических загрязнений на поверхности пластин
- •6.5.3. Методы анализа металлических загрязнений на поверхности пластин
- •6.5.4. Методы исследования рельефа поверхности подложек
- •6.6. Технологические процессы очистки поверхности полупроводниковых пластин
- •6.6.1. "Жидкостная" химическая обработка
- •6.6.2. Методы проведения "жидкостной" химической обработки
- •6.6.3. "Сухая" химическая обработка
- •6.7. Проблемы очистки поверхности полупроводниковых пластин
- •6.7.1. Влияние химической обработки на шероховатость поверхности Si пластин
- •6.7.2. Проблемы нежелательного формирования слоев оксида на поверхности кремниевых пластин
- •6.7.3. Органические загрязнения на поверхности полупроводниковых пластин
- •7. Физико-химические аспекты получения многослойных структур
- •7.1. Имплантация ионов водорода в кремниевые пластины
- •7.2. Особенности технологии прямого сращивания подложек
- •7.3. Сращивание пластин, покрытых SiO2
- •7.4. Состояние сращенных пластин
- •7.5. Плоскостность пластин
- •7.6. Утончение сращенных пластин
- •7.7. Микродефекты сращенных структур
- •7.8. Радиационные свойства многослойных структур
- •7.9. Движение и залечивание пор на границе сращивания стандартных пластин кремния
- •7.9.1. Скорость движения пор, связанных с диффузионными потоками в объеме матрицы, в поле температурного градиента
- •7.9.2. Скорость перемещения пор за счет диффузии атомов на ее поверхности в поле температурного градиента
- •7.9.3. Скорость перемещения пор за счет диффузии атомов в объеме в поле температурного градиента
- •7.9.4. Скорость движения пор в неоднородном поле напряжений при разных механизмах перемещения
- •7.9.5. Диффузионное движение пор вблизи границы кристалла, обусловленное поверхностной диффузией
- •7.9.6. Диффузионное движение пор под действием сил со стороны дислокаций
- •7.9.7. Рекристаллизация, спекание и залечивание пор
- •7.10. Пористый кремний в технологии прямого соединения
- •7.10.1. Теория и экспериментальные исследования заращивания пористых слоев
- •7.10.2 Осаждение слоев кремния на стенках пор и капилляров из парогазовых смесей
- •8. Исследование физико-химических свойств многослойных структур
- •8.1. Определение энергии связи прямого связывания пластин кремния методом генерации трещины между поверхностями сращивания
- •8.2. Исследование многослойных структур и материалов, используемых в процессе их производства эс, методами позитронной аннигиляционной спектроскопии
- •8.2.1. Сущность и особенности методов позитронной аннигиляционной спектроскопии
- •8.2.2. Теория метода ураф и результаты исследований
- •8.2.3. Определение концентрации электронов np в зоне проводимости металлов
- •8.2.4. Исследование полупроводников методом пас
- •8.3. Исследование поверхности пластин
- •8.3.1. Метод масс-спектрометрического исследования процесса термодесорбции с поверхности кремниевых пластин
- •8.3.2. Измерения контактной разности потенциалов подложек
- •8.3.3. Влияние адсорбции на электронные свойства поверхности твердых тел
- •Список литературы к главе 8
3.3 Направление протекания процессов.
Из 2-го начала ТД следует, что при необратимых процессах в системе возможно только увеличение энтропии, в крайнем случае возможно сохранение постоянства ее если процессы обратимы.
Т.о. система находится в устойчивом равновесии, если ее энтропия максимальна в данных условиях. Следовательно, общим условием протекания процесса в направлении устойчивого равновесия будет dS0. Условия равновесия можно выразить и через свободные потенциалы:
![]() (3.32)
(3.32)
Так при Т и V
=const,
решая уравнение, получим условие
![]() .
Следовательно, общим условием протекания
процесса в направлении достижения
устойчивого равновесия будет
.
Это значит, что в любой системе
самопроизвольно могут протекать только
те процессы, которые сопровождаются
уменьшением F.
Причем пределом их протекания, т.е.
условием равновесия является достижение
некоторого минимума значения F
для данных условий. Точно также при
постоянных температуре и давлении общим
условием протекания процессов в
направлении достижения равновесия
будет
.
Следовательно, общим условием протекания
процесса в направлении достижения
устойчивого равновесия будет
.
Это значит, что в любой системе
самопроизвольно могут протекать только
те процессы, которые сопровождаются
уменьшением F.
Причем пределом их протекания, т.е.
условием равновесия является достижение
некоторого минимума значения F
для данных условий. Точно также при
постоянных температуре и давлении общим
условием протекания процессов в
направлении достижения равновесия
будет
![]() .
.
Следовательно, в системах находящихся при постоянных Т и Р самопроизвольно могут протекать только процессы сопровождающиеся уменьшением энергии G, пределом их протекания служит Gmin для данных условий. Аналогично можно сформулировать и для других характеристических функций U и Н. Их значения тоже должны быть минимальными.
3.4 Химический потенциал
В ходе химических процессов происходит не только изменение таких параметров системы Р, V и Т, но также может изменяться состав системы, содержание составляющих ингредиентов. Применительно к таким системам для рассмотрения состояния равновесия Гиббс предложил использовать представления о химическом потенциале (ХП). Обозначается буквой μ. Математически ХП представляют в виде частных производных характеристических функций по числу молей данного компонента системы при постоянных значениях независимых параметров и количеств всех остальных компонентов (выбор характеристических функций определяется выбором независимых параметров системы).
Например: для многокомпонентной системы химический потенциал i-го компонента системы можно представить как
![]()
![]() (3.33)
(3.33)
![]() (3.34)
(3.34)
![]() (3.35)
(3.35)
![]() (3.36)
(3.36)
Если ввести мольные концентрации, то можно переписать эти уравнения
![]() (3.37)
(3.37)
![]() (3.38)
(3.38)
![]() (3.39)
(3.39)
Таким образом, ХП представляет собой ТД формулу состояния системы, определяющую изменение характеристической формулы при изменении количества частиц в системе. Так как U, H, F, G функции состояния системы, то при ni = const можно написать что
![]() (3.40)
(3.40)
Т.е. ХП μ вещества не зависит от выбора независимых переменных, а определяет состояние системы и представляет собой фактор интенсивности (степень погрешности химической энергии вещества в системе).
Фактором емкости будет число молей или концентрация данного вещества, следовательно, превращение химической энергии можно представить в виде μini или μixi, кроме того, в состоянии равновесия не происходит превращения химической энергии. Т.е.
![]() (3.41)
(3.41)
μi (ХП) – является мерой измерения характеристической функции при соответствующих постоянных параметрах и концентрациях всех веществ за исключением концентрации или массы того компонента, количество которого меняется в системе, следовательно, химический потенциал можно рассматривать как соответствующий тепловой эффект либо как совершаемую работу
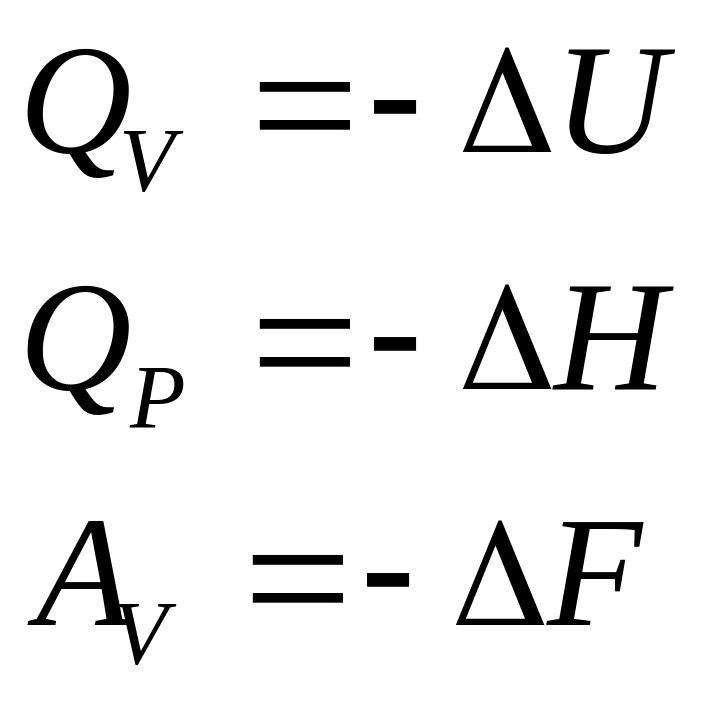 (3.42)
(3.42)
или
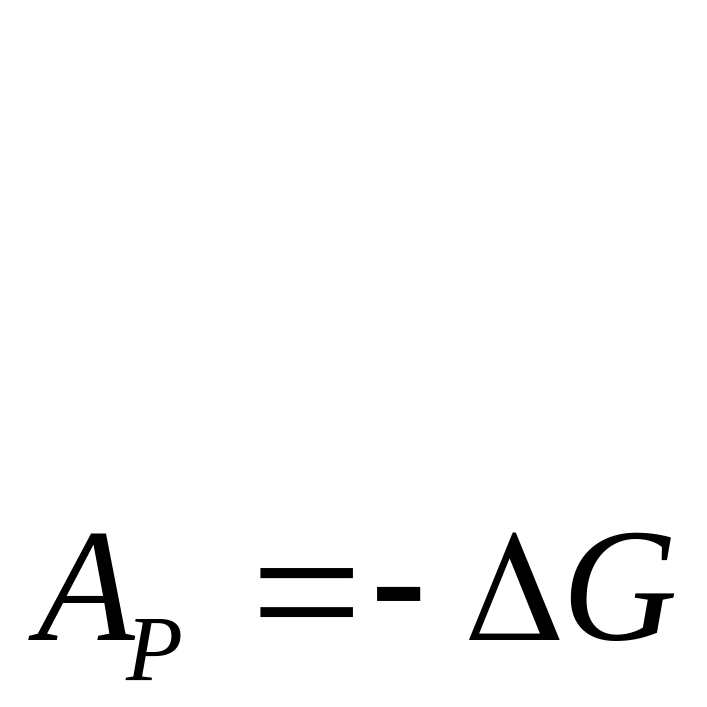 (3.43)
(3.43)
при изменении массы или концентрации вещества в системе.
Допустим, несколько систем образуют одну общую систему. В этом случае, фактор емкости равен сумме факторов емкости ее составных частей. При этом, если факторы интенсивности исходных систем одинаковы, то в новой системе существует равновесие.
В противном случае в новой системе начнется процесс, идущий в сторону выравнивания факторов интенсивности за счет изменения факторов емкости. Следовательно, для равновесия системы необходимо равенство химических потенциалов каждого вещества во всех участках системы.
Если рассмотреть пример системы, представляющей собой раствор из двух веществ (А и В), то взаимодействие между ними будет характеризоваться с помощью энергии взаимодействия разноименных (WAB) и одноименных (WAA, WBB) частиц. Для оценки этих взаимодействий вводят понятие энергии смешения, определяемое выражением W=
где можно видеть, что в зависимости от того, на сколько отличается изменения энергий одно- и разноименных частиц W может быть больше и меньше нуля.
Растворы W = 0 идеальные.
Растворы, в которых энергия системы не зависит от температуры и концентрации раствора называют регулярными. Идеальные растворы могут описываться с помощью уравнений для химических потенциалов.
![]() (3.44)
(3.44)
![]() (3.45)
(3.45)
Здесь
![]() -
называется нормальным химическим
потенциалом и определяется природой
веществ А и В. Для реальных растворов
общее уравнение химического потенциала
через G
выглядит:
-
называется нормальным химическим
потенциалом и определяется природой
веществ А и В. Для реальных растворов
общее уравнение химического потенциала
через G
выглядит:
![]() (3.46)
(3.46)
Отклонение поведения реального раствора от идеального, характеризуется с помощью величин:
ΔGсмешения = ΔНсмешения – ТΔSсмешения (3.47)
ΔНсмешения = XAXBW (3.48)
ΔSсмешения = - R(XAlnXA + XBlnXB) (3.49)
Третий вариант определения различий оценивается с помощью коэффициентов активности fA и fB.
fA = exp(- (1 – XA)2W) (3.50)
fB = exp(- (1 – XB)2W) (3.51)
Эти значения понадобятся для решения практических задач, в том числе и с применением кинетики процессов.
Вопросы для самопроверки:
1. Второй закон термодинамики. Дать определение по Томпсону, по Клаузиусу
2. Обратимые и необратимые процессы
3. Представит графически цикл Карно.
4. Дать математические формулы расчета КПД цикла Карно
5. Описать понятие энтропии
6. Представить объединенное уравнение 1-го и 2-го законов ТД.
7. Представить математические выражения характеристических функций ТД систем
8. Как можно определить направление протекания процессов
9. В каком случае раствор считается регулярным
10. Что представляет собой химический потенциал
Список использованных источников раздела 3
1. Глазов В.М. Основы физической химии. - М.: Высш. шк., 1981. - 456с.
2. Черняев В.Н. Физико-химические процессы в технологии РЭА. - М.: Высш. шк., 1987.-376с.
3. Карапетьянц М.Х. Введение в теорию химических процессов. - М.: Высш. шк., 1981. - 333с.
4 Фазовые равновесия и превращения.
Фазы кроме ФХ и ТД свойств различают еще и по агрегатному состоянию (твердое, жидкое, газообразное).
Для изучения равновесных состояний большинства используемых в МЭ систем можно ввести понятие конденсированной фазы (твердое состояние), получаемое из парогазовой или газовой фазы, а также использование представления о гомо- и гетерогенных системах.
Гомогенная система - это такая система, у которой нет частей, отделяющихся границами раздела. Пример: смесь газов, твердые или жидкие растворы ненасыщенные. Свойства такой системы или постоянны, или изменяются плавно при изменении концентрации или другого параметра (принцип непрерывности).
Гетерогенная система представляет собой смесь веществ с различной кристаллической решеткой (масло и вода). Т.е. это разнородная система, свойства которой на границах фаз меняются скачкообразно (принцип соответствия).
Следовательно, это система многофазная.
Рассмотрим несколько закрытых систем:
пар
лед
жидкость (насыщенный раствор NaCl
в H2O)
кристаллы NaCl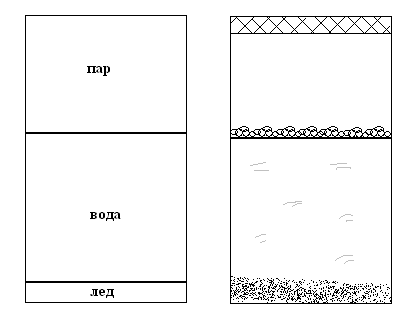
Рис. 4.1. Пример закрытой системы
Параметрами системы будем называть величины характеризующие систему и поддающиеся изменению при непосредственном воздействии на систему (V, p, T, C).
