- •Основний постулат і основна ідея статистичної фізики
- •Розподіл Максвела – приклад статистичного розподілу.
- •Фізичний зміст параметрів розподілу Максвела.
- •Тепер запишемо вирази для густини імовірності
- •Властивості і застосування максвелівського розподілу. Розподіл компонента швидкості
- •Розподіл Больцмана.
- •Мікроскопічний опис макроскопічних систем
- •Мікроскопічний опис класичної системи.
- •Фазовий простір.
- •Фазовий об’єм у - просторі.
- •Фазовий об’єм ідеального газу
- •Внаслідок незалежності координат і імпульсів частинок фазовий об’єм системи
- •Задання мікростану квантової системи.
- •Енергія всього газу системи
- •Розрахунок числа можливих станів для ідеального газу.
- •Співвідношення невизначеностей і число квантових станів.
- •Закони статистичного розподілу для систем багатьох частинок
- •Залежність функції розподілу від енергії системи.
- •2. Мікроканонічний розподіл.
- •Канонічний розподіл Гіббса.
- •Великий канонічний розподіл Гіббса.
- •Квантові статистики.
- •06601, Київ-30, вул. Пирогова, 9.
Енергія всього газу системи
![]() де
де![]()
Задання N наборів квантових чисел повністю визначає стан розглядуваного ідеального газу, Як бачимо, в цьому прикладі задання мікро стану звелось до опису квантових станів окремих частинок.
Розглядаючи стиснені гази, рідини і тверді тіла взаємодією молекул нехтувати не можна. В таких випадках потрібно говорити про стан системи в цілому. Однак є багато випадків коли взаємодія між частинками системи дуже мала і тому можна говорити про квантові стани окремих частин. Це можуть бути молекули або їх групи, блоки макроскопічних розмірів тощо. Назвемо їх квазінезалежними підсистемами. Взаємодія між ними проявляється лише в тому, що змушує підсистеми здійснювати переходи між допустимими для них квантовими станами.
Опис мікростану квантовою мовою полягає у перерахуванні квантових станів всіх квазінежалежних підсистем, з яких складається система.
Розрахунок числа можливих станів для ідеального газу.
В квантовій статистичній фізиці принципово важливо є така характеристика системи, як число можливих її квантових станів при заданих значеннях енергії і зовнішніх величин (параметрів).
Знайдемо це число для ідеального газу. Як окремі підсистеми тут виступають молекули.
Визначимо
спочатку число можливих мікро станів
однієї молекули при енергіях
![]()
Для
цього введемо умовний простір квантових
станів, в якому по осях декартових
координат відкладаються числа
![]() .
Кожне з цих чисел може набувати дискретних
значень від 1 до
.
Кожне з цих чисел може набувати дискретних
значень від 1 до
![]() ,
причому
визначається з формули (13):
,
причому
визначається з формули (13):
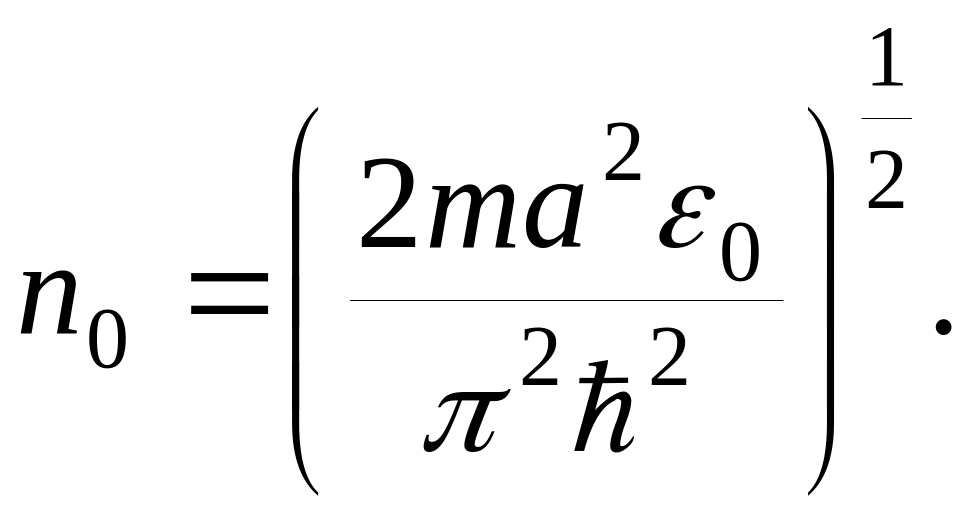
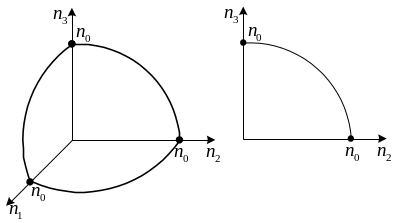
Кожній точці з цілими значеннями відповідає один стан. Точки, що зображають стани молекул, лежать у першому октанті в межах сфери радіуса .
|
Справа в тому, що на кожну точку припадає одиничний об’єм умовного простору. Отже число станів дорівнює
![]() (14)
(14)
де
![]() –
фізичний об’єм, який займає газ.
–
фізичний об’єм, який займає газ.
Оцінимо
значення
та
![]() для водню, який за нормальних умов займає
об’єм 1см3.
Середня енергія молекули
для водню, який за нормальних умов займає
об’єм 1см3.
Середня енергія молекули
![]() ,
,
![]() ,
,
![]() і
і
![]() .
.
Як
бачимо число допустимих станів для
однієї молекули дуже велике. Більше
того, дуже великим буде число станів,
яке припадає навіть на елементарний
інтервал енергії
![]() .
.
За формулою(14)
![]() (15)
(15)
Якщо
![]() і
і
![]() ,
що складає 0,0001 від середньої енергії
теплового руху, то
,
що складає 0,0001 від середньої енергії
теплового руху, то
![]() .
.
Всі
мікростани системи з двох незалежних
частинок можна одержати комбінуючи
кожен можливий стан першої частинки з
кожним допустимим станом другої. Якщо
перша частинка має
![]() різних станів, а друга -
різних станів, а друга -
![]() ,
то система характеризується числом
мікростанів
,
то система характеризується числом
мікростанів
![]() ,
рівним добутку
,
рівним добутку
![]() .
Для N
молекул ідеального газу число станів
дорівнює
.
Для N
молекул ідеального газу число станів
дорівнює
![]() .
.
Співвідношення невизначеностей і число квантових станів.
Розрахунки
числа квантових станів спрощуються,
якщо використати такий наближений
метод. Звернемо увагу на подібність
формул (7) і (15). Порівнюючи їх, бачимо, що
об’єм фазового простору
![]() ,
який відповідає всім станам однієї
частинки з енергією в інтервалі
,
який відповідає всім станам однієї
частинки з енергією в інтервалі
![]() ,
пропорційний числу квантових станів
тієї ж частинки, причому
,
пропорційний числу квантових станів
тієї ж частинки, причому
![]() (16)
(16)
Одержаний
результат можна узагальнити на довільну
систему, яка має
ступенів вільності. Число квантових
станів
![]() ,
яке відповідає елементу об’єму фазового
простору
,
визначається співвідношенням
,
яке відповідає елементу об’єму фазового
простору
,
визначається співвідношенням
![]() (17)
(17)
де
![]() .
.
Формулу (17) можна обґрунтувати так. З точки зору квантової механіки координата і спряжений їй імпульс не можуть бути задані одночасно точно
![]() (18)
(18)
Тому квантовому стану відповідає не фазова точка, а деякий об’єм фазового простору
![]() .
.
Для
макроскопічних систем з великою точністю
виконується наближена рівність
![]() .
Ця формула тим точніша, чим ближче рух
частинок до класичного, що можна бачити
на прикладі (16).
.
Ця формула тим точніша, чим ближче рух
частинок до класичного, що можна бачити
на прикладі (16).
Поступальний рух молекул ідеального газу є квазікласичним, Тому для одноатомного ідеального газу вірні формули
![]() (19)
(19)
![]() (20)
(20)
Зауважимо, що формули (17), (19) і (20) не враховують всіх квантових особливостей поведінки мікрочастинок. Зокрема, формула (17) не враховує внутрішніх студентів свободи, наприклад, спіна. Далі, формула (8) і (10) та (11), які з неї витікають, не враховують тотожності частинок. Врахування тотожності приводить до таких формул для ідеального газу
![]() (21)
(21)
![]() .
(22)
.
(22)