
- •Задание для самостоятельной работы по теме: "способы обработки экспериментального материала".
- •1. Правила построения таблиц.
- •2. Основные назначения графиков.
- •3. Правила построения графиков
- •4. Правила округления чисел.
- •5. Погрешности измерений.
- •А. Ошибки прямых измерений.
- •Тема № 2
- •Тема № 3
- •Лабораторная работа №1 «Определение константы калориметра по известному тепловому эффекту процесса»
- •Тема № 4
- •I. Мотивация цели:
- •Лабораторная работа№2
- •Тема № 5
- •Лабораторная работа №3
- •Тема № 7
- •Примеры решения задач
- •Решение.
- •Решение:
- •Тема № 8
- •Примеры решения задач
- •Решение
- •Лабораторная работа №10
- •Примечания:
- •Тема №9 свойства буферных растворов
- •I план изучения темы
- •V Лабораторная работа
- •1. Зависимость рН буферного раствора от соотношения концентраций компонентов и от разведения.
- •1) Приготовить три ацетатных буферных раствора с различным соотношением концентраций компонентов.
- •VI. Литература:
- •Тема №10 буферная емкость
- •I план изучения темы
- •VI. Литература:
- •Тема №11 формальная химическая кинетика
- •Лабораторная работа
- •Тема №12 кинетика химических реакций различных порядков
- •Лабораторная работа
- •Тема №13 влияние температуры на скорость химической реакции.
- •Лабораторная работа
- •Тема №14 основы фармакокинетики
- •I. План
- •II. Цель самоподготовки
- •VI. Литература.
Лабораторная работа№2
«Определение теплоты растворения хорошо растворимой соли».
При растворении соли в жидкости имеют место два процесса: разрушение кристаллической решетки – эндотермический процесс и сольватация (гидратация) ионов - экзотермический процесс. В зависимости от соотношения этих тепловых эффектов, которое определяется природой растворенного вещества и растворителя, теплота растворения соли может быть как положительной (Н > 0), так и отрицательной (Н < 0) величиной.
Выделяют понятие интегральная теплота растворения – тепловой эффект растворения 1 моль вещества в таком количестве растворителя, который образует раствор определенной моляльности (b).
ВИД ДЕЙСТВИЯ |
СПОСОБ ДЕЙСТВИЯ |
1. Собрать калориметр и провести «предварительный период» калориметрического опыта. |
1. Смотреть 1 и 2 этапы работы предыдущего занятия. |
2. Провести «главный» и «заключительный периоды» калориметрического опыта. |
1. На 5-й минуте опыта, не отключая мешалку и секундомер, открыть пробку и быстро всыпать 5 г хлорида аммония. 2. Продолжить записывать температуру через каждую минуту до тех пор, пока вся соль не растворится и не установится изменение температуры, не превышающее 0,010С. После этого записать еще 3-4 показания термометра. |
3. Определить изменение температуры t калориметрического опыта. |
1. Результаты измерений «предварительного” и “заключительного периодов” калориметрического опыта занести в таблицу (см. приложение к лабораторной работе №1) 2. На основании полученных данных построить график t = f(). По графику определить t. |
4. Рассчитать удельную и интегральную теплоты растворения соли.
|
где К – постоянная калориметра, m – масса растворенной соли, г, а также интегральную теплоту растворения:
М – молярная масса соли. |
5. Вычислить погрешность опыта, используя табличное значение интегральной теплоты растворения хлорида аммония. |
|
Тема № 5
ТЕРМОДИНАМИЧЕСКИЕ ПОТЕНЦИАЛЫ. ХИМИЧЕСКИЙ ПОТЕНЦИАЛ
I. МОТИВАЦИЯ ЦЕЛИ: Термодинамическими потенциалами, или характеристическими функциями, называют термодинамические функции, которые содержат в себе всю термодинамическую информацию о системе. Наибольшее значение имеют четыре основных термодинамических потенциала:
1) внутренняя энергия U(S,V),
2) энтальпия H(S,p) = U + pV,
3) энергия Гельмгольца F(T,V) = U - TS,
4) энергия Гиббса G(T,p) = H - TS = F + pV.
В скобках указаны термодинамические параметры, которые получили название естественных переменных для термодинамических потенциалов. Все эти потенциалы имеют размерность энергии и не имеют абсолютного значения, поскольку определены с точностью до постоянной, которая равна внутренней энергии при абсолютном нуле.
Зависимость термодинамических потенциалов от их естественных переменных описывается основным уравнением термодинамики, которое объединяет первое и второе начала. Это уравнение можно записать в четырех эквивалентных формах:
dU = TdS - pdV (5.1)
dH = TdS + Vdp (5.2)
dF = - pdV - SdT (5.3)
dG = Vdp - SdT (5.4)
Эти уравнения записаны в упрощенном виде - только для закрытых систем, в которых совершается только механическая работа.
Зная любой из четырех потенциалов как функцию естественных переменных, можно с помощью основного уравнения термодинамики найти все другие термодинамические функции и параметры системы (см. пример 5-1).
Другой важный смысл термодинамических потенциалов состоит в том, что они позволяют предсказывать направление термодинамических процессов. Так, например, если процесс происходит при постоянных температуре и давлении, то неравенство, выражающее второй закон термодинамики:
![]()
эквивалентно
неравенству dGp,T
![]() 0
(мы учли, что при постоянном давлении
0
(мы учли, что при постоянном давлении
![]() Qp
= dH),
где знак равенства относится к обратимым
процессам, а неравенства - к необратимым.
Таким образом, при необратимых процессах,
протекающих при постоянных температуре
и давлении, энергия Гиббса всегда
уменьшается. Минимум энергии Гиббса
достигается при равновесии.
Qp
= dH),
где знак равенства относится к обратимым
процессам, а неравенства - к необратимым.
Таким образом, при необратимых процессах,
протекающих при постоянных температуре
и давлении, энергия Гиббса всегда
уменьшается. Минимум энергии Гиббса
достигается при равновесии.
В общем случае, любой термодинамический потенциал в необратимых процессах при постоянстве естественных переменных уменьшается и достигает минимума при равновесии:
Потенциал |
Естественные переменные |
Условие самопроизвольности |
Условия равновесия |
U |
S = const, V = const |
dU < 0 |
dU = 0, d 2U > 0 |
H |
S = const, p = const |
dH < 0 |
dH = 0, d 2H > 0 |
F |
T = const, V = const |
dF < 0 |
dF = 0, d 2F > 0 |
G |
T = const, p = const |
dG < 0 |
dG = 0, d 2G > 0 |
II. ЦЕЛЬ САМОПОДГОТОВКИ:
Изучить термодинамические потенциалы как меру работоспособности системы и как критерии направления процесса.
Усвоить соотношения между основными характеристическими функциями системы.
3. Овладеть методом расчета изменения термодинамических потенциалов в химических реакциях.
4. Научиться оценивать возможность, направление и предел протекания химической реакции с позиций химической термодинамики.
III. ИСХОДНЫЙ УРОВЕНЬ ЗНАНИЙ: изменение внутренней энергии, энтропии, энтальпии, способы их расчета, законы термодинамики.
IV. П Л А Н И З У Ч Е Н И Я Т Е М Ы:
1. Максимальная и максимальная полезная работа.
2. Энергия Гиббса. Физический смысл. G как функция состояния.
3. Энергия Гельмгольца. Физический смысл. F как функция состояния.
4. Связь изменения энергии Гиббса или энергии Гельмгольца с работой процесса.
5. Свободная и связанная энергия.
6. Характеристические функции, взаимосвязь между ними.
7. Зависимости энергии Гиббса и энергии Гельмгольца от параметров состояния и состава системы.
8. Объединенное уравнение I и II законов термодинамики. Уравнение Гиббса-Гельмгольца.
9. Термодинамические критерии направления и предела протекания самопроизвольных процессов.
10. Способы расчета изменений энергии Гиббса и энергии Гельмгольца в химических реакциях. Стандартная энергия Гиббса.
11. Полный и частный дифференциал для систем с постоянным и переменным составом.
12. Химический потенциал как фактор интенсивности. Химический потенциал идеального и реального газа. Фугитивность и аддитивность реального газа, методы их определения.
V. ЛИТЕРАТУРА:
А.П. Беляева и др. Физическая и коллоидная химия. М.: ГЭОТАР-Медиа, 2008, с. 64-69.
К.С. Краснов Физическая химия. - М., Высшая школа, 2001, с. 241-251.
Евстратова К. И., Купина Н. А., Малахова Е.Е. Физическая и коллоидная химия М., 1990, с. 42-50.
Киреев В. А. Краткий курс физической химии М. 1978, с.217-237.
Стромберг А. Г., Семченко Д.П. Физическая и коллоидная химия, М. 1999, с. 94-107.
Лекционный материал.
VI. ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ:
1. Приведите математическое выражение, отражающее соотношение между:
а) энергией Гиббса и энергией Гельмгольца;
б) энергией Гиббса и энтальпией системы;
в) энергией Гельмгольца и внутренней энергией.
2. Какой термодинамический потенциал следует выбрать в качестве критерия протекания самопроизвольного процесса при условии постоянства:
а) температуры и давления;
б) температуры и объема.
3. Перечислите условия, выполнение которых служит критерием термодинамического равновесия в системе:
а) изолированной;
б) находящейся при p = const и T = const;
в) находящейся при V = const и T = const;
в) находящейся при V = const и S = const
в) находящейся при p = const и S = const
4. Какой знак будет иметь величина G для процесса перехода жидкого бензола при 273 К в твердое состояние при той же температуре? Температура плавления бензола равна 278,5 К. Какое состояние бензола - жидкое или твердое - является более устойчивым при 273 К?
5. Для
реакции Н2
+ Cl2
![]() 2HCl изменение энергии Гиббса при 248 К
равно -190,5 кДж. Может ли эта реакция
протекать самопроизвольно? Ответ
обосновать.
2HCl изменение энергии Гиббса при 248 К
равно -190,5 кДж. Может ли эта реакция
протекать самопроизвольно? Ответ
обосновать.
6. При работе гальванического элемента Даниэля-Якоби протекает химическая реакция: Zn + CuCl2 ZnCl2 + Cu. Как изменяется величина G этой реакции?
7. Какие условия необходимо соблюдать, чтобы максимальная работа в системе совершалась за счет убыли энергии Гиббса?
8. В каком соотношении находятся полезная работа, совершенная системой над окружающей средой, и изменение энергии Гельмгольца, если процесс протекает:
а) обратимо;
б) необратимо.
9. Как изменяется энергия Гельмгольца при изотермическом сжатии газа в идеальном состоянии?
10. Напишите уравнение, связывающее изменение энергии Гиббса, температурный коэффициент изменения энергии Гиббса и тепловой эффект процесса при постоянном давлении.
11. Назовите три этапа в расчете изменения изобарного потенциала химической реакции, протекающей в стандартных условиях, если известны значения стандартных теплот образования и стандартных энтропий участников химической реакции.
12. Дайте определение понятию "стандартная энергия Гиббса образования".
13. Приведите уравнение для расчета изменения энергии Гиббса химической реакции по значениям стандартных энергий Гиббса образования всех участников этой реакции.
VII. ОБЯЗАТЕЛЬНЫЕ ДЛЯ ВЫПОЛНЕНИЯ ЗАДАНИЯ:
Примеры решения задач
Пример 5-1. Внутренняя энергия некоторой системы известна как функция энтропии и объема, U(S,V). Найдите температуру и теплоемкость этой системы.
Решение. Из основного уравнения термодинамики (5.1) следует, что температура - это частная производная внутренней энергии по энтропии:
![]() .
.
Изохорная теплоемкость определяет скорость изменения энтропии с температурой:
![]() .
.
Воспользовавшись свойствами частных производных, можно выразить производную энтропии по температуре через вторую производную внутренней энергии:
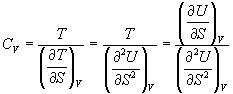 .
.
Пример 5-2. Используя основное уравнение термодинамики, найдите зависимость энтальпии от давления при постоянной температуре: а) для произвольной системы; б) для идеального газа.
Решение. а) Если основное уравнение в форме (5.2) поделить на dp при постоянной температуре, получим:
![]() .
.
Производную энтропии по давлению можно выразить с помощью соотношения Максвелла для энергии Гиббса (5.13):
![]() .
.
б) Для идеального газа V(T) = nRT / p. Подставляя эту функцию в последнее тождество, получим:
![]() .
.
Энтальпия идеального газа не зависит от давления.
Пример 5-3.
Выразите производные
![]() и
и
![]() через
другие термодинамические параметры.
через
другие термодинамические параметры.
Решение. Основное уравнение термодинамики (5.1) можно переписать в виде:
![]() ,
,
представив энтропию как функцию внутренней энергии и объема. Коэффициенты при dU и dV равны соответствующим частным производным:
![]() .
.
Пример 5-4.
Два моль гелия (идеальный газ, мольная
теплоемкость Cp
= 5/2 R)
нагревают от 100 оС
до 200 оС
при p
= 1 атм. Вычислите изменение энергии
Гиббса в этом процессе, если известно
значение энтропии гелия -
![]() =
131.7 Дж/(моль.
К). Можно ли считать этот процесс
самопроизвольным?
=
131.7 Дж/(моль.
К). Можно ли считать этот процесс
самопроизвольным?
Решение. Изменение энергии Гиббса при нагревании от 373 до 473 К можно найти, проинтегрировав частную производную по температуре (5.6):
![]() .
.
Зависимость энтропии от температуры при постоянном давлении определяется изобарной темлоемкостью:
![]() .
.
Интегрирование этого выражения от 373 К до T дает:
![]() .
.
Подставляя это выражение в интеграл от энтропии, находим:

Процесс нагревания не обязан быть самопроизвольным, т.к. уменьшение энергии Гиббса служит критерием самопроизвольного протекания процесса только при T = const и p = const.
Ответ. G = -26850 Дж.
Пример 5-5. Рассчитайте изменение энергии Гиббса в реакции
CO + 1/2O2 = CO2
при температуре 500 K и парциальных давлениях 3 бар. Будет ли эта реакция самопроизвольной при данных условиях? Газы считать идеальными. Необходимые данные возьмите из справочника.
Решение. Термодинамические данные при температуре 298 К и стандартном давлении 1 бар сведем в таблицу:
Вещество |
Энтальпия
образования
кДж/моль |
Энтропия
Дж/(моль.К) |
Теплоемкость
Дж/(моль.К) |
CO |
-110.5 |
197.6 |
29.14 |
O2 |
0 |
205.0 |
29.40 |
CO2 |
-393.5 |
213.7 |
34.57 |
Реакция |
, кДж/моль |
|
, Дж/(моль.К) |
CO + 1/2O2 = CO2 |
-283.0 |
-86.4 |
-9.27 |
Примем, что Cp = const. Изменения термодинамических функций в результате реакции рассчитаны как разность функций реагентов и продуктов:
f = f(CO2) - f(CO) - f(O2).
Стандартный тепловой эффект реакции при 500 К можно рассчитать по уравнению Кирхгофа в интегральной форме:

Стандартное изменение энтропии в реакции при 500 К можно рассчитать по формуле:

Стандартное изменение энергии Гиббса при 500 К:
![]()
Для расчета изменения энергии Гиббса при парциальных давлениях 3 атм необходимо проинтегрировать формулу
![]()
и использовать условие идеальности газов (V = nRT/p, n - изменение числа молей газов в реакции):
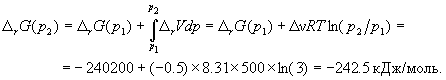
Эта реакция может протекать самопроизвольно при данных условиях.
Ответ. G = -242.5 кДж/моль.
5-1. Выразите внутреннюю энергию как функцию переменных G, T, p.
5-2. Используя основное уравнение термодинамики, найдите зависимость внутренней энергии от объема при постоянной температуре: а) для произвольной системы; б) для идеального газа.
5-3. Известно, что внутренняя энергия некоторого вещества не зависит от его объема. Как зависит давление вещества от температуры? Ответ обоснуйте.
5-4. Напишите выражение для бесконечно малого изменения энтропии как функции внутренней энергии и объема. Найдите частные производные энтропии по этим переменным и составьте соответствующее уравнение Максвелла.
5-5. Для некоторого вещества известно уравнение состояния p(V, T). Как изменяется теплоемкость Cv с изменением объема? Решите задачу: а) в общем виде; б) для какого-либо конкретного уравнения состояния (кроме идеального газа).
5-6. Нарисуйте график зависимости энергии Гиббса индивидуального вещества от температуры в интервале от 0 до T > Tкип.
5-7. Вычислите изменение H, U, F, G, S при одновременном охлаждении от 2000 К до 200 К и расширении от 0.5 м3 до 1.35 м3 0.7 молей азота (CV = 5/2 R). Энтропия газа в исходном состоянии равна 150 Дж/(моль. К), газ можно считать идеальным.
5-8. Вычислите изменение энергии Гиббса при сжатии от 1 атм до 3 атм при 298 К: а) одного моля жидкой воды; б) одного моля водяного пара (идеальный газ).
5-9. Изменение энергии Гиббса в результате испарения воды при 95 оС и 1 атм равно 546 Дж/моль. Рассчитайте энтропию паров воды при 100 оС, если энтропия жидкой воды равна 87.0 Дж/(моль. К). При каком давлении изменение энергии Гиббса в результате испарения воды будет равно 0 при 95 оС?
5-10.
Вычислите стандартную энергию Гиббса
образования (![]() )
жидкой и газообразной воды, если известны
следующие данные:
)
жидкой и газообразной воды, если известны
следующие данные:
![]() (H2O(г))
= -241.8 кДж/моль,
(H2O(ж))
= -285.6 кДж/моль,
(H2O(г))
= -241.8 кДж/моль,
(H2O(ж))
= -285.6 кДж/моль,
![]() (H2)
= 130.6 Дж/(моль.
К),
(O2)
= 205.0 Дж/(моль.
К),
(H2O(г))
= 188.5 Дж/(моль.
К),
(H2O(ж))
= 69.8 Дж/(моль.
К).
(H2)
= 130.6 Дж/(моль.
К),
(O2)
= 205.0 Дж/(моль.
К),
(H2O(г))
= 188.5 Дж/(моль.
К),
(H2O(ж))
= 69.8 Дж/(моль.
К).
5-11. Рассчитайте Go при 25 оС для химической реакции:
4HCl(г) + O2(г) = 2Cl2(г) + 2H2O(ж).
Стандартные значения энтальпии образования и абсолютной энтропии при 25 оС равны: fHo(HСl) = -22.1 ккал/моль, fHo(H2O(ж)) = -68.3 ккал/моль; So(HCl) = 44.6 кал/(моль. K), So(O2) = 49.0 кал/(моль. K), So(Сl2) = 53.3 кал/(моль. K), So(H2O(ж)) = 16.7 кал/(моль. K).
5-12. Рассчитайте Go при 25 оС для химической реакции:
CO2(г) + 4H2(г) = CH4(г) + 2H2O(ж).
Стандартные значения энтальпии образования и абсолютной энтропии при 25 оС равны: fHo(СO2) = -94.1 ккал/моль, fHo(СH4) = -17.9 ккал/моль, fHo(H2O(ж)) = -68.3 ккал/моль; So(СO2) = 51.1 кал/(моль. K), So(H2) = 31.2 кал/(моль. K), So(СH4) = 44.5 кал/(моль. K), So(H2O(ж)) = 16.7 кал/(моль. K).
5-13. Рассчитайте стандартные энергии Гиббса и Гельмгольца Go и Fo при 300 оС для химической реакции:
CO(г) + 3H2(г) = CH4(г) + H2O(г).
Может ли эта реакция протекать самопроизвольно при данной температуре? Теплоемкости веществ считать постоянными.
5-14.
Найдите энергию Гиббса образования NH3
при температурах 298 и 400 K, если известны
следующие данные:
![]() (NH3)
= -46.2 кДж/моль,
(NH3)
= -46.2 кДж/моль,
Вещество |
N2 |
H2 |
NH3 |
Cp,298, Дж/(моль. К) |
29.1 |
28.8 |
35.7 |
, Дж/(моль. К) |
191.5 |
130.6 |
192.5 |
Считать, что теплоемкости в указанном интервале температур постоянны.
5-15. Рассчитайте стандартные энергии Гиббса и Гельмгольца Go и Fo при 60 оС для химической реакции:
CH3COOH(ж) + 2H2(г) = C2H5OH(ж) + H2O(ж).
Может ли эта реакция протекать самопроизвольно при данной температуре? Теплоемкости веществ считать постоянными.
5-16. Рассчитайте стандартные энергии Гиббса и Гельмгольца Go и Fo при 700 оС для химической реакции:
CaCO3(тв) = CaO(тв) + CO2(г).
Может ли эта реакция протекать самопроизвольно при данной температуре? Теплоемкости веществ считать постоянными.
VIII. ПЛАН РАБОТЫ НА ПРЕДСТОЯЩЕМ ЗАНЯТИИ:
1. Контроль и коррекция выполнения домашнего задания.
2. Разбор основных теоретических вопросов темы.
3. Решение задач.
4. Тестовый контроль.
5. Выполнение лабораторной работы “Определение теплоты нейтрализации сильного основания сильной кислотой”.
