
- •1. Вступ
- •1.1. Предмет і мета дисципліни "Фізична хімія"
- •1.4. Тематичний план та зміст лекційного курсу 6 тетраместру
- •1.5. Індивідуальні та домашні завдання для самостійної роботи студентів
- •2. Розрахункові завдання
- •2.1. Основні поняття хімічної термодинаміки
- •2.1.1. Основні визначення
- •2.1.2. Перший закон термодинаміки
- •2.1.3. Закон Геса
- •2.1.4. Теплоємність
- •2.1.5. Закон Кірхгофа
- •2.1.6. Другий закон термодинаміки
- •2.1.7. Постулат Планка
- •2.1.8. Термодинамічні потенціали
- •2.1.9. Рівняння Гібса-Гельмгольца
- •2.1.10. Хімічний потенціал.
- •2.1.11. Хімічна рівновага. Стандартна і емпіричні константи рівноваги.
- •2.1.12. Рівняння ізотерми хімічної реакції Вант-Гофа
- •2.1.13. Рівняння ізобари і ізохори хімічної реакції. Вплив температури, тиску і домішок інертних газів на рівновагу реакції.
- •2.1.14. Обчислення констант рівноваги із стандартних величин термодинамічних функцій за рівнянням Тьомкіна – Шварцмана.
- •2.2. Приклади розв'язання задач
- •2. При адіабатичному стисненні робота розраховується наступним чином:
- •Використовуючи отримане значення т2 визначаємо роботу адіабатичного стиснення
- •Визначаємо зміну ентропії для реакції при стандартних умовах (величини ентропій вихідних речовин та продуктів реакції відповідно даних з довідника):
- •Рівноважна 3-3/4·х 1-1/4·х х Константа рівноваги має такий вираз
- •Прореагувало і утворилося 3х х 4х
- •Тоді, константа рівноваги Кn складає:
- •Якщо тепловий ефект δн не залежить від температури, тоді тепловий ефект хімічної реакції визначаємо за наближеною формою рівняння ізобари:
- •2.3. Багатоваріантні задачі
- •3. Индивідуальне розрахунково-графічне завдання
- •3.1. Пояснення для вирішення завдання
- •3.1.1. Розрахунок константи рівноваги хімічної реакції
- •3.1.2 Розрахунки виходу продуктів реакції
- •3.1.3. Розрахунок залежності виходу аміаку від тиску та температури
- •3.1.4. Розрахунки рівноваги в реальних системах
- •3.2. Багатоваріантне графічно-розрахункове завдання
- •4. Перелік контрольних запитань
- •4.1. Перелік запитань для самоконтролю
- •4.2. Питання до екзаменаційних білетів
- •4.2.1. Теплоємність, перше начало термодинаміки, термохімія
- •4.2.2. Друге і третє начало термодинаміки
- •4.2.3. Хімічна рівновага
- •5. Нарахування рейтингових балів
- •5.1. Таблиця відповідності рейтингових балів за національною та європейською шкалами
- •5.2. Правила нарахування рейтингових балів
- •5.3. Таблиця відповідності оцінок та балів за європейською і національною шкалами
- •6. Список рекомендованої літератури Основна література
- •Перелік позначень
Рівноважна 3-3/4·х 1-1/4·х х Константа рівноваги має такий вираз
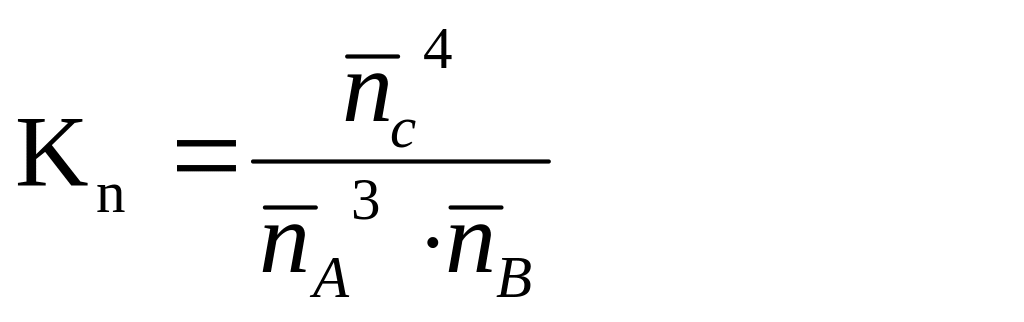
Тоді
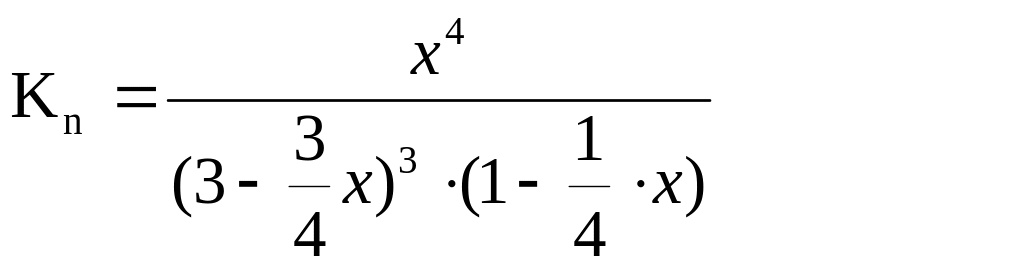
Спростив вираз, отримаємо
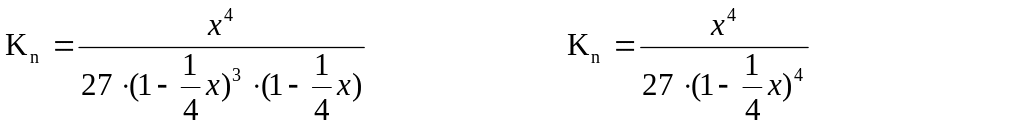
Кр пов’язана з Кn і Кс наступними співвідношеннями:
![]() Кр
= Кс(RT)
Δn
Кр
= Кс(RT)
Δn
Кількість речовини в рівноважній системі складає
Σn = 3 - 3/4·х + 1 - 1/4·х + х = 4, а Δn = 4 – (3 + 1) = 0.
Оскільки
Δn = 0, то таким чином, відповідь:
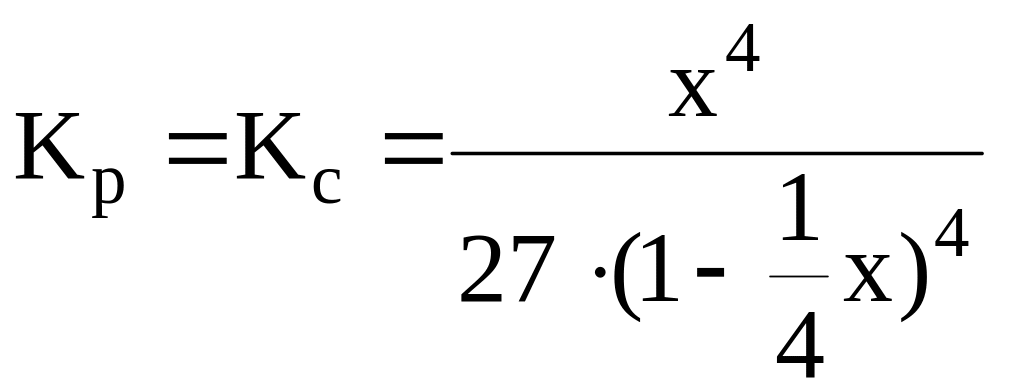
Варіант Б.
За умовами задачі А та В взяли в стехіометричних кількостях, тобто n0A = 3 моль і n0В = 1 моль. Виражаємо рівноважні кількості А та В, прийняв, що рівноважна кількість С дорівнює 4х.
Кількість, моль 3А + В = 4С
Вихідна 3 1 0
Прореагувало і утворилося 3х х 4х
Рівновага 3-3х 1-х 4х
Тоді, константа рівноваги Кn складає:
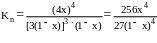

Оскільки
Δn = 0, то:
![]()
Відповідь:
![]()
Приклад 2.2.10. Константа рівноваги хімічної реакції при 590ºС
С6Н5С2Н5(г.) → С6Н5С2Н3(г.) + Н2
дорівнює Кх = 6,70·10-2. Визначити максимальний вихід стиролу.
Розв’язання
Константа рівноваги для хімічної реакції дорівнює за умовою завдання
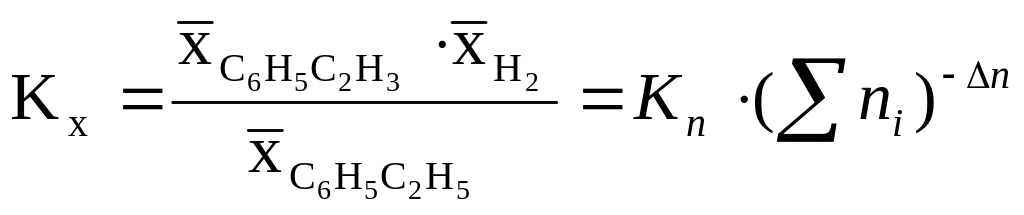 ,
,
де
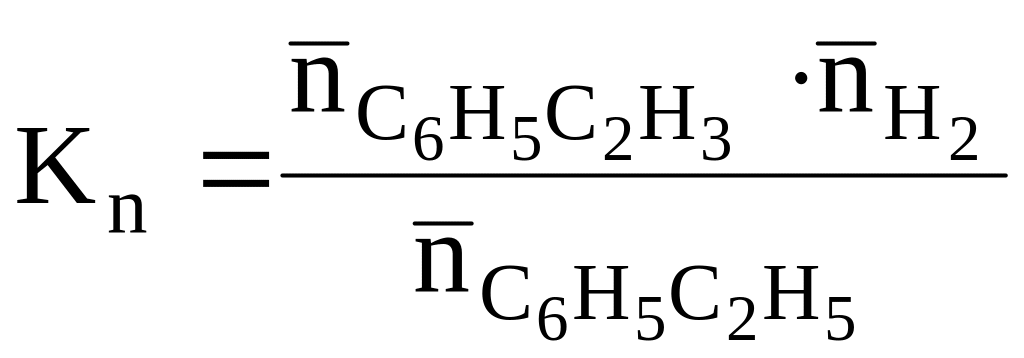
Тоді, оскільки Δn = (1+1)-1= 1, рівняння перетворюється у:
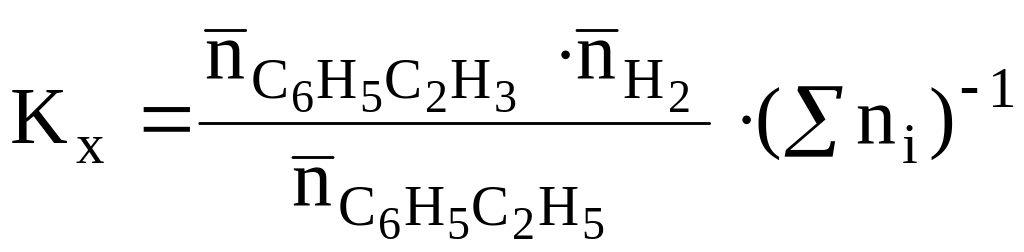
За
умовчанням приймаємо, що вихідна речовина
введена до системи у стехіометричній
кількості. Складаємо рівняння, виражаючи
склад рівноважної системи та Кх
через кількість стиролу С6Н5С2Н3,
тобто
![]() .
.
С6Н5С2Н5(г.) → С6Н5С2Н3(г.) + Н2
Склад вихідної суміші, моль 1 0 0
Склад рівноважної суміші, моль 1-у у y
Отже, кількість речовини у рівноважній суміші:
![]() =
1 - у + у + у = 1 + у
=
1 - у + у + у = 1 + у
Підставимо знайдені вирази до попереднього рівняння та розв’яжемо отримане рівняння
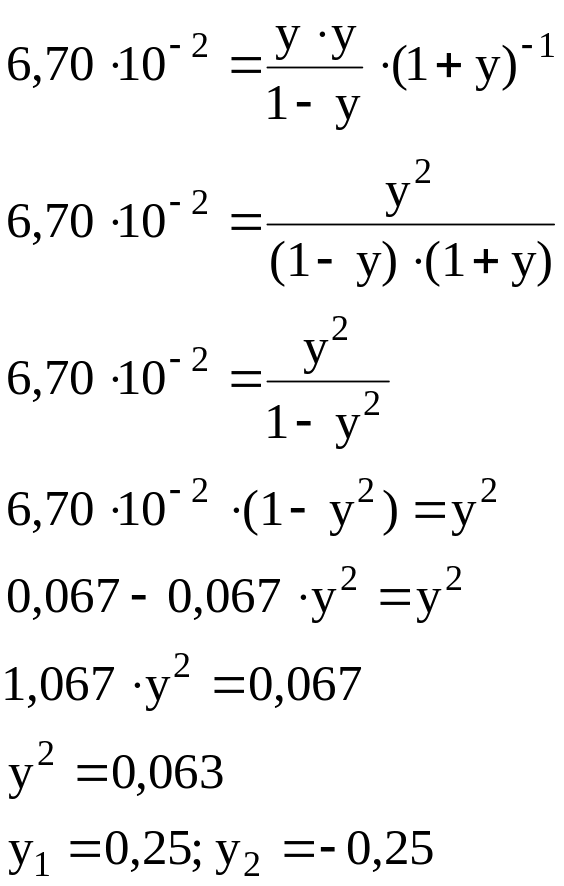
Оскільки корінь у2 не має фізичного сенсу, обираємо у1. Таким чином, максимальна кількість стиролу в рівноважній суміші складає 0,25 моль, а його максимальний вихід:
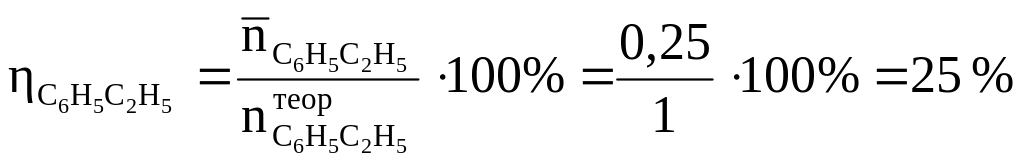
Відповідь:
![]()
Приклад 2.2.11. Константа рівноваги (К0) хімічної реакції синтезу етилацетату: С2Н5ОН(г.) + СН3СООН(г.) → СН3СООС2Н5(г.) + Н2О(г.), дорівнює при 573 К 9,00, а при 423 К – 30,0. Розрахуйте тепловий ефект цієї реакції.
Розв’язання
Якщо тепловий ефект δн не залежить від температури, тоді тепловий ефект хімічної реакції визначаємо за наближеною формою рівняння ізобари:
ln(K02/K01) = ΔН·(T2 – T1)/R·T2·T1 .
Звідси: ΔН=R·T2·T1·ln(K02/K01)/(T2–T1)=8,314·423·573·ln(30,0/9,00)/(423–573) = -16,2·103 Дж/моль
Відповідь: ΔН = -16,2·103 Дж/моль
Приклад 2.2.12. Для хімічної реакції: 4СО + 2SО2 = S2 + 4CO2, розрахуйте стандартну спорідненість при 600 К.
Розв’язання
1) Стандартну спорідненість (стандартну зміну енергії Гібса) при температурі Т розраховуємо за методом Тьомкіна – Шварцмана:
ΔG0Т = ΔН0298 - Т · ΔS0298 - Т · (Δа · М0 + Δb · М1 + Δc · М2 + Δc´ · М-2).
2) Визначаємо тепловий ефект реакціі при 298 К:
ΔН0298 = (4·ΔН0f,298(CO2)+ΔН0f,298(S2))-(4·ΔН0f,298(СО)+2·ΔН0f,298(SО2)) =
(4·(-393,51)+128,37)-(4·(-110,53) + 2·(-296,9)) = -409,75 кДж.
3) Обчислюємо зміну ентропії при 298 К:
ΔS0298 = (4·S0298(CO2)+S0298(S2))-(4·S0298(СО)+2·S0298(SО2)) = (4·213,66+228,03) -(4·197,55+2·248,07) = -203,67 Дж/K.
4) Розраховуємо коефіцієнти в рівнянні ΔСр° = f (Т).
-
Речовина
Ср0 = f (Т),
Дж/(моль · К)
Температурний інтервал, К
а
b · 103
с´·10-5
CO2
44,14
9,04
-8,54
298 – 2500
S2
36,11
1,09
-3,51
298 – 2000
SО2
46,19
7,87
-7,70
298 – 2000
СО
28,41
4,10
-0,46
298 – 2500
Δ а = (4·а(СО2) + а (S2))-(4·а(СО) + 2·а(SО2))= (4·44,14 + 36,11)-(4·28,41 + 2·46,19)= 6,65
За аналогією розраховуємо Δ b та Δ с´:
Δ b = 5,11 · 10-3; Δ с´ = -20,43 · 105
Оскільки вихідні речовини та продукти реакції є неорганічними речовинами, Δс = 0.
Для T = 600 K згідно з довідником : М0 = 0,1962; М1 = 0,0759·103; М2 = 0,0303·106; М-2 = 0,1423·10-5.
Тоді, стандартна зміна енергії Гібса при 600 К складає:
ΔG0600 = -409750 - 600 · (-203,67) - 600 · (6,65· 0,1962 + 5,11· 10-3 · 0,0759 · 103 + 0 · 0,0303 · 106 + (-20,43 · 105) · 0,1423 · 10-5) = -286,82·103 Дж
Відповідь: ΔG0600 = -286,82 кДж.
