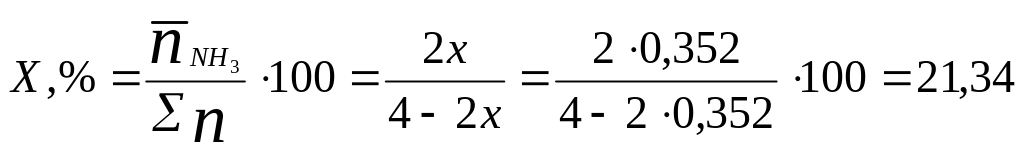- •1. Вступ
- •1.1. Предмет і мета дисципліни "Фізична хімія"
- •1.4. Тематичний план та зміст лекційного курсу 6 тетраместру
- •1.5. Індивідуальні та домашні завдання для самостійної роботи студентів
- •2. Розрахункові завдання
- •2.1. Основні поняття хімічної термодинаміки
- •2.1.1. Основні визначення
- •2.1.2. Перший закон термодинаміки
- •2.1.3. Закон Геса
- •2.1.4. Теплоємність
- •2.1.5. Закон Кірхгофа
- •2.1.6. Другий закон термодинаміки
- •2.1.7. Постулат Планка
- •2.1.8. Термодинамічні потенціали
- •2.1.9. Рівняння Гібса-Гельмгольца
- •2.1.10. Хімічний потенціал.
- •2.1.11. Хімічна рівновага. Стандартна і емпіричні константи рівноваги.
- •2.1.12. Рівняння ізотерми хімічної реакції Вант-Гофа
- •2.1.13. Рівняння ізобари і ізохори хімічної реакції. Вплив температури, тиску і домішок інертних газів на рівновагу реакції.
- •2.1.14. Обчислення констант рівноваги із стандартних величин термодинамічних функцій за рівнянням Тьомкіна – Шварцмана.
- •2.2. Приклади розв'язання задач
- •2. При адіабатичному стисненні робота розраховується наступним чином:
- •Використовуючи отримане значення т2 визначаємо роботу адіабатичного стиснення
- •Визначаємо зміну ентропії для реакції при стандартних умовах (величини ентропій вихідних речовин та продуктів реакції відповідно даних з довідника):
- •Рівноважна 3-3/4·х 1-1/4·х х Константа рівноваги має такий вираз
- •Прореагувало і утворилося 3х х 4х
- •Тоді, константа рівноваги Кn складає:
- •Якщо тепловий ефект δн не залежить від температури, тоді тепловий ефект хімічної реакції визначаємо за наближеною формою рівняння ізобари:
- •2.3. Багатоваріантні задачі
- •3. Индивідуальне розрахунково-графічне завдання
- •3.1. Пояснення для вирішення завдання
- •3.1.1. Розрахунок константи рівноваги хімічної реакції
- •3.1.2 Розрахунки виходу продуктів реакції
- •3.1.3. Розрахунок залежності виходу аміаку від тиску та температури
- •3.1.4. Розрахунки рівноваги в реальних системах
- •3.2. Багатоваріантне графічно-розрахункове завдання
- •4. Перелік контрольних запитань
- •4.1. Перелік запитань для самоконтролю
- •4.2. Питання до екзаменаційних білетів
- •4.2.1. Теплоємність, перше начало термодинаміки, термохімія
- •4.2.2. Друге і третє начало термодинаміки
- •4.2.3. Хімічна рівновага
- •5. Нарахування рейтингових балів
- •5.1. Таблиця відповідності рейтингових балів за національною та європейською шкалами
- •5.2. Правила нарахування рейтингових балів
- •5.3. Таблиця відповідності оцінок та балів за європейською і національною шкалами
- •6. Список рекомендованої літератури Основна література
- •Перелік позначень
3.1.4. Розрахунки рівноваги в реальних системах
Вихід
аміаку за реакцією (N2
+3H2
= 2NH3),
як ми встановили, зростає зі збільшенням
загального тиску в системі. Тому в
промисловості синтез аміаку здійснюється
при високих температурах (Т ≈ 723 К), з
метою збільшення швидкості процесу, та
високих тисках (![]() ≥ 300), для збільшення виходу продукту.
≥ 300), для збільшення виходу продукту.
Розрахунок за рівнянням Тьомкіна - Шварцмана при Т = 723 К дає значення константи рівноваги К0 = 6,5 *10-3.
Максимальна доля перетворення, що знайдена при вказаним значенні параметрів за рівнянням (3.21)
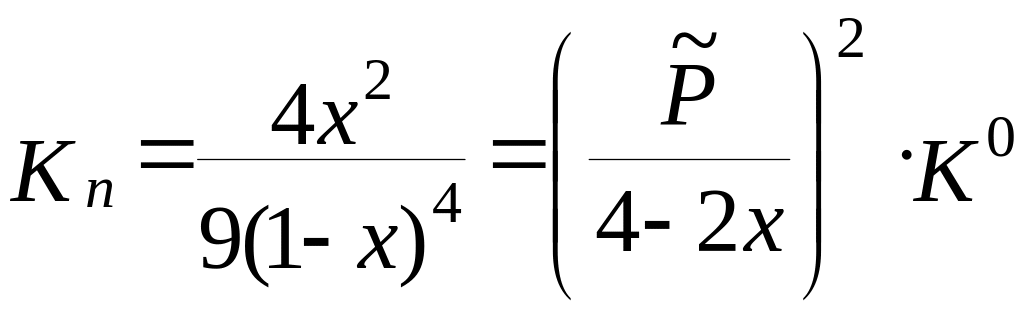 ,
де
,
де
![]() - приведений тиск.
- приведений тиск.
або
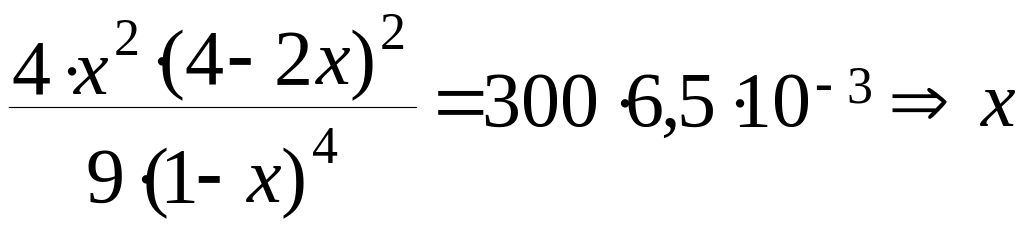 складає
Хрозрах.
= 0,309.
складає
Хрозрах.
= 0,309.
В
той же час доля перетворення, що знайдена
дослідним шляхом складає Хдослід.
= 0,355. Як виявилося при відносних тисках
![]() > 20 (Р = 20 · 1,013·105
Па)
гази не підкоряються законам, які
виведені для ідеальних систем. Для
переходу від ідеальних до реальних
систем газам замість рівняння стану
Менделєєва – Клапейрона: PV=RT
> 20 (Р = 20 · 1,013·105
Па)
гази не підкоряються законам, які
виведені для ідеальних систем. Для
переходу від ідеальних до реальних
систем газам замість рівняння стану
Менделєєва – Клапейрона: PV=RT
прийнято використовувати рівняння Ван-дер-Ваальса:
![]() (3.26)
(3.26)
де V – мольний об’єм газу, м3; Р – тиск, Па; а – стала, що враховує взаємне притягання молекул; b - стала, що враховує власний об’єм молекули.
Вираз для хімічного потенціалу ідеального газу:
![]() (3.27)
(3.27)
для реальних газів має вигляд:
![]() (3.28)
(3.28)
де
![]() – летючість (фугітивність), яка пов’язана
з тиском наступним співвідношенням:
– летючість (фугітивність), яка пов’язана
з тиском наступним співвідношенням:
![]() (3.29)
(3.29)
де γі – коефіцієнт летючості (активності) реального газу.
Таким
чином, якщо стала рівноваги реакції
синтезу аміаку, що знайдена при
стандартному тиску:
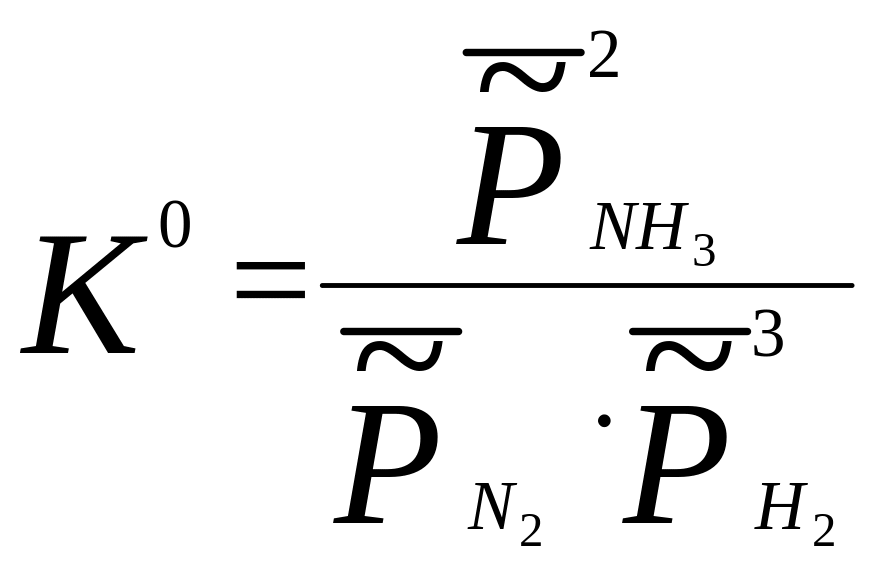
то при високих тисках стала рівноваги буде мати вигляд :
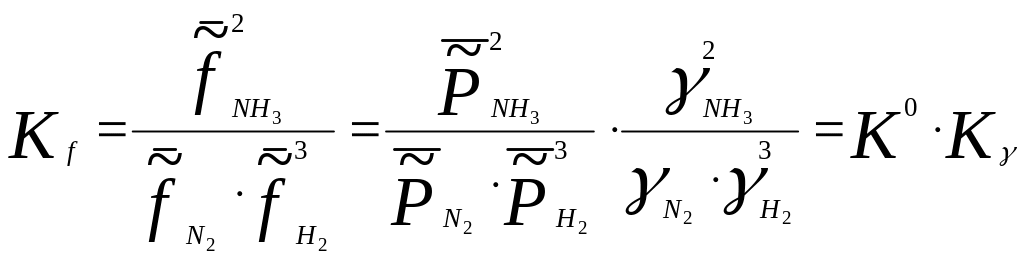 (3.30)
(3.30)
Таким чином, при високих тисках за рівнянням Тьомкіна - Шварцмана ми розраховуємо не К0, а Кf та для того щоб визначити сталу рівноваги при стандартних тисках потрібно знати Кγ:
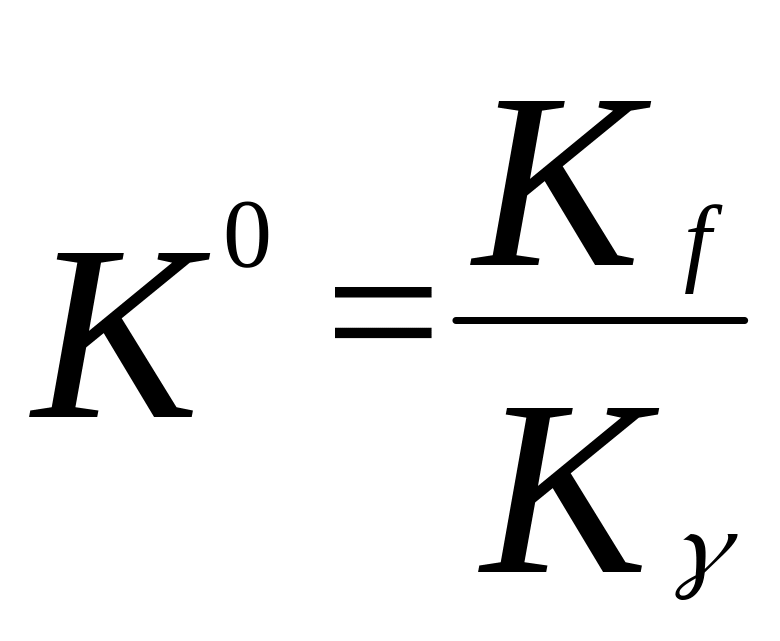 (3.31)
(3.31)
Для визначення коефіцієнтів летючості (активності) необхідно скористатися рівнянням стану реальних газів, наприклад рівнянням Ван-дер-Ваальса. Однак в цьому рівнянні коефіцієнти a та b індивідуальні для кожного газу. Тому використовують рівняння Ван-дер-Ваальса в приведених параметрах, яке не вміщує (в явному вигляді) індивідуальних сталих, та може бути використано для любих речовин:
![]()
π
- приведений тиск,
![]() ;
τ - приведена температура,
;
τ - приведена температура,
![]() ;
;
φ
- приведений об’єм,
![]() ;
;
Критична температура (Ткр) – це температура при якій у рідині, що запаяна в ампулі зникає межа поділу рідина – пар. Тиск, який при цьому досягається в ампулі називається критичним (Ркр), а об’єм 1 молю рідини дорівнює критичному об’єму (Vкр).
Для
водню, гелію та неону:
![]() ;
;
![]() .
.
Як
виявилося, коефіцієнти летючості
(активності) реальних газів визначаються
величинами π та τ (![]() ).
Приведена залежність визначається за
допомогою теореми відповідних станів,
яка сформульована Ван-дер-Ваальсом у
1881 році:
).
Приведена залежність визначається за
допомогою теореми відповідних станів,
яка сформульована Ван-дер-Ваальсом у
1881 році:
Якщо два приведених параметра одного газу дорівнюють двом приведеним параметрам іншого, то ці гази знаходяться у відповідному стані, тобто їх властивості в однаковому ступені відрізняються від властивостей ідеальних газів.
Одним із наслідків цієї теореми є твердження, що у відповідних станах любих газів їх коефіцієнти активності однакові. Це дозволило побудувати єдині для всіх речовин залежності , які у вигляді таблиць та діаграм приведені у довідковій літературі.
Повернемося до процесу синтезу аміаку
N2 +3H2 = 2NH3
при
Т = 723 К та відносному тиску
![]() і за допомогою довідкових даних запишемо
критичні та приведені параметри речовин,
що приймають участь в реакції, а потім
знайдемо у довіднику коефіцієнти
активності (таблиця 3.1.4.)
і за допомогою довідкових даних запишемо
критичні та приведені параметри речовин,
що приймають участь в реакції, а потім
знайдемо у довіднику коефіцієнти
активності (таблиця 3.1.4.)
Таблиця 3.1.4
Критичні та приведені параметри реакції синтезу аміаку при Т = 723 К та = 300
-
Компо-нент
Ткр
π
γі
Н2
33,2
17,5
12,8
14,4
1,09
N2
126,0
5,73
33,6
8,93
1,14
NH3
406,0
1,78
111,6
2,69
0,91
Знайдені за таблицями значення підставляємо у вираз для сталої рівноваги:

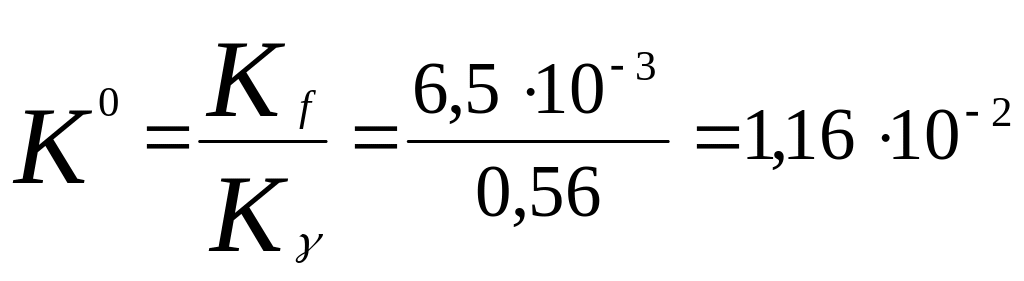
З урахуванням значення К0 знаходимо долю перетворення х:
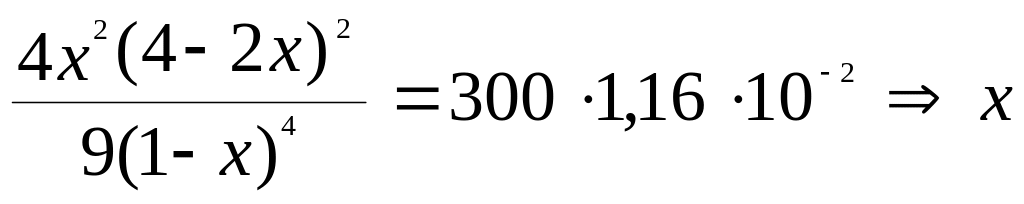
![]() розрах
= 0,352, що відповідає дослідному значенню
хдослід
=
0,355.
розрах
= 0,352, що відповідає дослідному значенню
хдослід
=
0,355.
Вихід аміаку при вказаних параметрах складе: