
- •1. Вступ
- •1.1. Предмет і мета дисципліни "Фізична хімія"
- •1.4. Тематичний план та зміст лекційного курсу 6 тетраместру
- •1.5. Індивідуальні та домашні завдання для самостійної роботи студентів
- •2. Розрахункові завдання
- •2.1. Основні поняття хімічної термодинаміки
- •2.1.1. Основні визначення
- •2.1.2. Перший закон термодинаміки
- •2.1.3. Закон Геса
- •2.1.4. Теплоємність
- •2.1.5. Закон Кірхгофа
- •2.1.6. Другий закон термодинаміки
- •2.1.7. Постулат Планка
- •2.1.8. Термодинамічні потенціали
- •2.1.9. Рівняння Гібса-Гельмгольца
- •2.1.10. Хімічний потенціал.
- •2.1.11. Хімічна рівновага. Стандартна і емпіричні константи рівноваги.
- •2.1.12. Рівняння ізотерми хімічної реакції Вант-Гофа
- •2.1.13. Рівняння ізобари і ізохори хімічної реакції. Вплив температури, тиску і домішок інертних газів на рівновагу реакції.
- •2.1.14. Обчислення констант рівноваги із стандартних величин термодинамічних функцій за рівнянням Тьомкіна – Шварцмана.
- •2.2. Приклади розв'язання задач
- •2. При адіабатичному стисненні робота розраховується наступним чином:
- •Використовуючи отримане значення т2 визначаємо роботу адіабатичного стиснення
- •Визначаємо зміну ентропії для реакції при стандартних умовах (величини ентропій вихідних речовин та продуктів реакції відповідно даних з довідника):
- •Рівноважна 3-3/4·х 1-1/4·х х Константа рівноваги має такий вираз
- •Прореагувало і утворилося 3х х 4х
- •Тоді, константа рівноваги Кn складає:
- •Якщо тепловий ефект δн не залежить від температури, тоді тепловий ефект хімічної реакції визначаємо за наближеною формою рівняння ізобари:
- •2.3. Багатоваріантні задачі
- •3. Индивідуальне розрахунково-графічне завдання
- •3.1. Пояснення для вирішення завдання
- •3.1.1. Розрахунок константи рівноваги хімічної реакції
- •3.1.2 Розрахунки виходу продуктів реакції
- •3.1.3. Розрахунок залежності виходу аміаку від тиску та температури
- •3.1.4. Розрахунки рівноваги в реальних системах
- •3.2. Багатоваріантне графічно-розрахункове завдання
- •4. Перелік контрольних запитань
- •4.1. Перелік запитань для самоконтролю
- •4.2. Питання до екзаменаційних білетів
- •4.2.1. Теплоємність, перше начало термодинаміки, термохімія
- •4.2.2. Друге і третє начало термодинаміки
- •4.2.3. Хімічна рівновага
- •5. Нарахування рейтингових балів
- •5.1. Таблиця відповідності рейтингових балів за національною та європейською шкалами
- •5.2. Правила нарахування рейтингових балів
- •5.3. Таблиця відповідності оцінок та балів за європейською і національною шкалами
- •6. Список рекомендованої літератури Основна література
- •Перелік позначень
Визначаємо зміну ентропії для реакції при стандартних умовах (величини ентропій вихідних речовин та продуктів реакції відповідно даних з довідника):
ΔS0298 = (2 · S0298(Н2О(р.)) + 4 · S0298(СН3СООН(р.))) - (5 · S0298(O2) + 2 · S0298(С4Н10(г.))) = ((2 · 69,95 + 4 · 159,83) - (5 · 205,04 + 2 · 310,12) = -866,22 Дж/К.
Відповідь: ΔS0298 = -866,22 Дж/К.
Приклад 2.2.4. 100 г водню при 298 К розширюються в вакуум, займаючи втричі більший об’єм. Обчисліть зміну ентропії, вважаючи водень ідеальним газом.
Розв’язання
Розширення водню відбувається при сталій температурі, тому скористаємось рівнянням:
ΔS = n·R·ln(V2/V1),
де кількість речовини n = 100/2 = 50 моль, а V2/V1 =3 за умовами завдання.
Отже, зміна ентропії складає:
ΔS = 50·8,314·ln3 = 457 Дж/К.
Відповідь: ΔS = 457 Дж/К.
Приклад 2.2.5. Розрахуйте збільшення ентропії при змішуванні 100 см3 кисню та 200 см3 азоту при 298 К та 1,013 · 105 Па.
Розв’язання
1. Зміна ентропії при змішуванні двох газів дорівнює сумі змін ентропії кожного з газів при зворотному ізотермічному розширенні від початкового об’єму V1 або V2 до кінцевого V1 + V2:
ΔS = ΔS1 + ΔS2,
де ΔS1 = n1·R·ln((V1 + V2)/V1) та ΔS2 = n2·R·ln((V1 + V2)/V2).
Розраховуємо кількість кисню n1 та азоту n2 за рівнянням стану ідеального газу:
P·V = n·R·T <=> n = P·V/R·T.
Тоді: n1 = P·V1/R·T = 1,013 · 105 · 100 · 10-6/8,314 · 298 = 0,0041 моль;
n2 = P·V2/R·T = 1,013 · 105 · 200 · 10-6/8,314 · 298 = 0,0082 моль.
Визначаємо зміну ентропії кисню та азоту:
ΔS1 = 0,0041·8,314·ln((100 · 10-6 + 200 · 10-6)/100 · 10-6) = 0,037 Дж/К,
ΔS2 = 0,0082·8,314·ln((100 · 10-6 + 200 · 10-6)/200 · 10-6) = 0,028 Дж/К.
Тоді, збільшення ентропії при змішуванні кисню та азоту:
ΔS = 0,037 + 0,028 = 0,065 Дж/К.
Відповідь: ΔS = 0,065 Дж/К.
Приклад 2.2.6. Визначте роботу ізобарного зворотного розширення 5 моль ідеального газу при його нагріванні від 298 до 400 К.
Розв’язання
Роботу ізобарного розширення визначаємо за рівнянням:
W = P·(V2 – V1).
Для ідеальних газів воно набуває вигляд:
W = n·R·(Т2 – Т1).
Тоді: W = 5 · 8,314 · (400 - 298) = 4,240 · 103 Дж.
Відповідь: 4,240 · 103 Дж.
Приклад 2.2.7. Для реакцій а) Mg(OH)2 = MgO + H2O(г); б) Al2O3(корунд) + 3SO3 = Al2(SO4)3(кр.), які перебігають при 400 К, визначте, наскільки за цих умов відрізняються теплові ефекти при сталому тиску і сталому об’ємі.
Розв’язання
Тепловий ефект при постійному тиску дорівнює: Qp = ΔH = ΔU + P·ΔV, а для ідеальних газів:
Qp = ΔH = ΔU + Δn·R·T,
де Δn – зміна кількості молів газоподібних речовин під час проходження реакції.
Тепловий ефект при сталому об’ємі дорівнює QV = ΔU. Тоді, різниця теплових ефектів хімічної реакції в ізобарному та ізохорному процесах визначається наступним чином:
Qp - QV = ΔH - ΔU = ΔU + Δn·R·T - ΔU = Δn·R·T.
Визначаємо Δn для реакції а) Mg(OH)2 = MgO + H2O(г):
Δn = 1 - 0 = 1 (враховуємо тільки газоподібні речовини)
Тоді: Qp - QV = 1 · 8,314 · 400 = 3326 Дж.
Розраховуємо Δn для реакції б) Al2O3(корунд) + 3SO3 = Al2(SO4)3(кр.):
Δn = 0 - 3 = -3
Тоді: Qp - QV = -3 · 8,314 · 400 = -9977 Дж.
Відповідь: а) 3326 Дж.; б) -9977 Дж.
Приклад 2.2.8. Для реакції: 4СО + 2SО2 = S2 + 4CO2
1)обчислить за теплотами утворення ізобарний тепловий ефект при стандартних умовах;
2)розрахуйте коефіцієнти рівняння ΔСр = f(T) (Δа, Δb, Δc, Δc´) і вкажіть інтервал температур, для якого справедлива ця залежність;
3) за результатами розрахунку визначить тепловий ефект при 700 К та Р = 101325 Па.
Необхідні дані для розрахунку приведені в довіднику [6].
Дано: 4СО + 2SО2 = S2 + 4CO2
Знайти: ΔН0T = f (Т); ΔН0700 – ?
Розв’язання
1) Визначаємо ізобарний тепловий ефект реакції при стандартних умовах, беручи до уваги слідство із закону Геса (величини теплот утворення вихідних речовин та продуктів реакції виписуємо з довідника [6]):
ΔН0298 = (4·ΔН0f,298 (CO2) + ΔН0f,298 (S2)) - (4·ΔН0f,298 (СО) + 2·ΔН0f,298 (SО2)) = (4·(-393,51) + +128,37) - (4·(-110,53) + 2·(-296,9)) = -409,75 кДж.
2) Визначаємо коефіцієнти в рівнянні ΔСр0 = f (Т). Виписуємо у таблицю з довідника емпіричні коефіцієнти багаточленів Ср0 = f (Т) для продуктів реакції та вихідних речовин. За їх значенням розраховуємо коефіцієнти в рівнянні ΔСр0 = f (Т).
-
Речовина
Ср0 = f (Т),
Дж/(моль · К)
Температурний інтервал, К
а
b · 103
с´·10-5
CO2
44,14
9,04
-8,54
298 – 2500
S2
36,11
1,09
-3,51
298 – 2000
SО2
46,19
7,87
-7,70
298 – 2000
СО
28,41
4,10
-0,46
298 – 2500
Δ а = (4·а(СО2) + а (S2))-(4·а(СО) + 2·а(SО2))= (4·44,14 + 36,11)-(4·28,41 + 2·46,19) = 6,65
За аналогією розраховуємо Δ b та Δ с´:
Δ b = 5,11 · 10-3
Δ с´ = -20,43 · 105
Інтервал температур, в якому справедливі розраховані коефіцієнти, визначаємо за найменшим з усіх температурних інтервалів для реагуючих речовин.
Тоді, для даної реакції в інтервалі температур 298 – 2000 К отримаємо:
ΔС0р = 6,65 + 5,11· 10-3 · Т - 20,43· 105/Т2
3) Залежність ΔНr0 = f (Т) визначається за законом Кирхгоффа:

Підставивши в попереднє рівняння значення ізобарного теплового ефекту реакції при стандартних умовах та коефіцієнтів Δа, Δb та Δс´, отримаємо ΔН0Т = f(Т)
![]()
Підставивши Т = 700 К, визначаємо тепловий ефект реакції ΔН0700 :
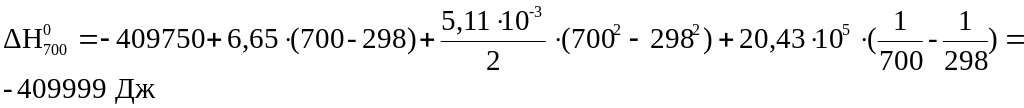 Відповідь:
ΔН0700
=
-410 кДж/моль.
Відповідь:
ΔН0700
=
-410 кДж/моль.
Приклад 2.2.9. Газоподібні речовини А і В реагують з утворенням газоподібної речовини С:
3А + В = 4С
Виразіть Кр і Кс через рівноважну кількість речовини С, якщо А та В взяли в стехіометричних кількостях при загальному тиску в системі Р і температурі Т, К.
Розв’язання
Варіант А.
За умовами задачі А та В взяли в стехіометричних кількостях, тобто n0A = 3 моль і n0В = 1 моль. Визначаємо рівноважні кількості А та В, прийняв до уваги, що рівноважна кількість С дорівнює х.
Кількість, моль 3А + В = 4С
Вихідна 3 1 0
