
- •1. Вступ
- •1.1. Предмет і мета дисципліни "Фізична хімія"
- •1.4. Тематичний план та зміст лекційного курсу 6 тетраместру
- •1.5. Індивідуальні та домашні завдання для самостійної роботи студентів
- •2. Розрахункові завдання
- •2.1. Основні поняття хімічної термодинаміки
- •2.1.1. Основні визначення
- •2.1.2. Перший закон термодинаміки
- •2.1.3. Закон Геса
- •2.1.4. Теплоємність
- •2.1.5. Закон Кірхгофа
- •2.1.6. Другий закон термодинаміки
- •2.1.7. Постулат Планка
- •2.1.8. Термодинамічні потенціали
- •2.1.9. Рівняння Гібса-Гельмгольца
- •2.1.10. Хімічний потенціал.
- •2.1.11. Хімічна рівновага. Стандартна і емпіричні константи рівноваги.
- •2.1.12. Рівняння ізотерми хімічної реакції Вант-Гофа
- •2.1.13. Рівняння ізобари і ізохори хімічної реакції. Вплив температури, тиску і домішок інертних газів на рівновагу реакції.
- •2.1.14. Обчислення констант рівноваги із стандартних величин термодинамічних функцій за рівнянням Тьомкіна – Шварцмана.
- •2.2. Приклади розв'язання задач
- •2. При адіабатичному стисненні робота розраховується наступним чином:
- •Використовуючи отримане значення т2 визначаємо роботу адіабатичного стиснення
- •Визначаємо зміну ентропії для реакції при стандартних умовах (величини ентропій вихідних речовин та продуктів реакції відповідно даних з довідника):
- •Рівноважна 3-3/4·х 1-1/4·х х Константа рівноваги має такий вираз
- •Прореагувало і утворилося 3х х 4х
- •Тоді, константа рівноваги Кn складає:
- •Якщо тепловий ефект δн не залежить від температури, тоді тепловий ефект хімічної реакції визначаємо за наближеною формою рівняння ізобари:
- •2.3. Багатоваріантні задачі
- •3. Индивідуальне розрахунково-графічне завдання
- •3.1. Пояснення для вирішення завдання
- •3.1.1. Розрахунок константи рівноваги хімічної реакції
- •3.1.2 Розрахунки виходу продуктів реакції
- •3.1.3. Розрахунок залежності виходу аміаку від тиску та температури
- •3.1.4. Розрахунки рівноваги в реальних системах
- •3.2. Багатоваріантне графічно-розрахункове завдання
- •4. Перелік контрольних запитань
- •4.1. Перелік запитань для самоконтролю
- •4.2. Питання до екзаменаційних білетів
- •4.2.1. Теплоємність, перше начало термодинаміки, термохімія
- •4.2.2. Друге і третє начало термодинаміки
- •4.2.3. Хімічна рівновага
- •5. Нарахування рейтингових балів
- •5.1. Таблиця відповідності рейтингових балів за національною та європейською шкалами
- •5.2. Правила нарахування рейтингових балів
- •5.3. Таблиця відповідності оцінок та балів за європейською і національною шкалами
- •6. Список рекомендованої літератури Основна література
- •Перелік позначень
2.1.13. Рівняння ізобари і ізохори хімічної реакції. Вплив температури, тиску і домішок інертних газів на рівновагу реакції.
Рівняння
ізобари:
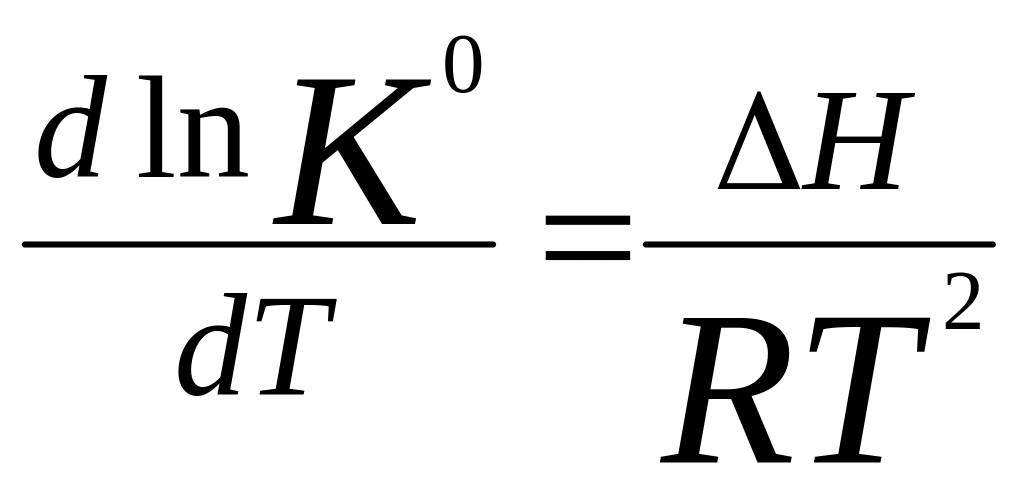 та
ізохори:
та
ізохори:
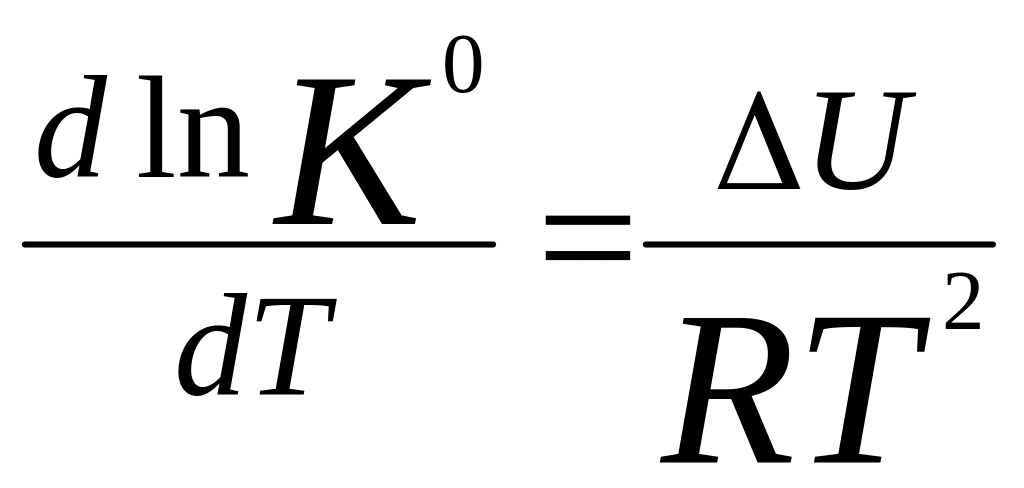 , дають кількісну оцінку впливу температури
на константу рівноваги.
, дають кількісну оцінку впливу температури
на константу рівноваги.
Принцип зсуву рівноваги Ле Шательє: якщо на систему, що знаходиться в рівновазі, діяти зовні, змінюючи якийсь параметр, процес відбувається в напрямку, який применшує зовнішній вплив. Цей принцип дає якісну оцінку впливу різних факторів на рівновагу.
Для
екзотермічних реакцій
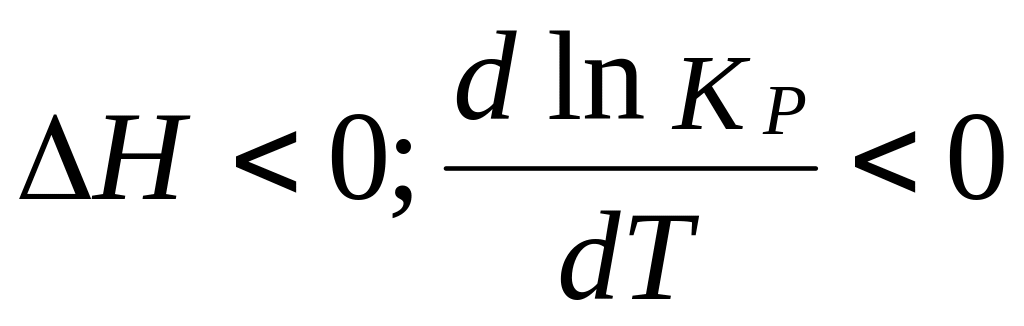 – убуваюча функція. Тож, підвищення Т
призводить до зменшення КР
та виходу продуктів реакції.
– убуваюча функція. Тож, підвищення Т
призводить до зменшення КР
та виходу продуктів реакції.
Для
ендотермічних реакцій
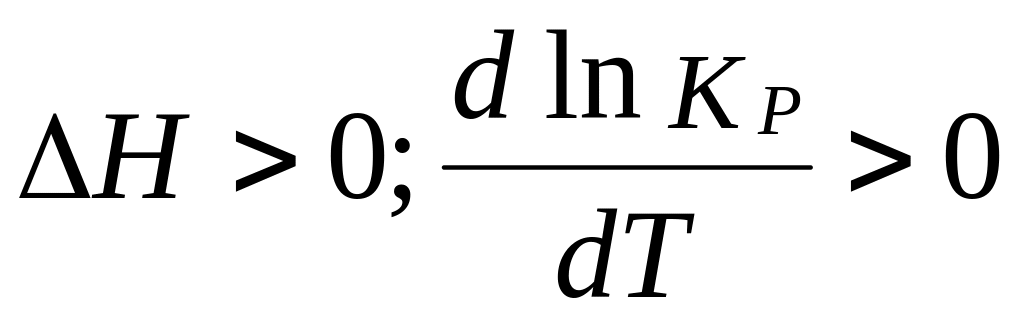 – зростаюча функція. Підвищення Т
зумовлює збільшення КР
та виходу продуктів реакції.
– зростаюча функція. Підвищення Т
зумовлює збільшення КР
та виходу продуктів реакції.
Таким чином, збільшення температури при екзотермічних процесах призводить до зменшення Кр та виходу продукту реакції, при ендотермічних процесах - до збільшення Кр та виходу продукту реакції.
Вплив
тиску та інертних газів на стан рівноваги
визначається з аналізу рівняння:
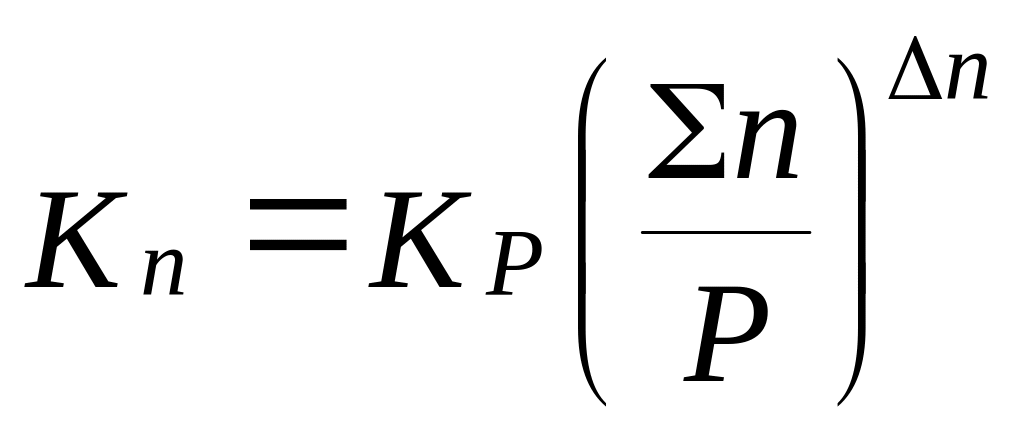 .
.
Якщо
в реакції
![]() <
0, збільшення загального тиску приводить
до збільшення Кn
та виходу продукту реакції. Якщо в
реакції
>
0, збільшення загального тиску приводить
до зменшення Кn
та виходу продукту реакції. Тож, підвищення
тиску зміщує рівновагу в бік меншого
числа молей газоподібних речовин.
Введення інертних газів збільшує
величину
<
0, збільшення загального тиску приводить
до збільшення Кn
та виходу продукту реакції. Якщо в
реакції
>
0, збільшення загального тиску приводить
до зменшення Кn
та виходу продукту реакції. Тож, підвищення
тиску зміщує рівновагу в бік меншого
числа молей газоподібних речовин.
Введення інертних газів збільшує
величину
![]() .
.
Якщо реакція перебігає без зміни числа молей ( = 0), то зміна тиску та введення інертних газів не впливає на стан рівноваги: KP = KC = Kn=К0 .
2.1.14. Обчислення констант рівноваги із стандартних величин термодинамічних функцій за рівнянням Тьомкіна – Шварцмана.
Більш точну оцінку впливу температури можна зробити на основі рівняння Тьомкіна – Шварцмана:
![]() ,
,
де
![]() - стандартний тепловий ефект реакції;
- стандартний тепловий ефект реакції;
![]() - стандартна зміна ентропії для реакції;
- стандартна зміна ентропії для реакції;
![]() - емпіричні коефіцієнти, які залежать
лише від температури.
- емпіричні коефіцієнти, які залежать
лише від температури.
2.2. Приклади розв'язання задач
Приклад
2.2.1.
Дійсна молярна теплоємність бора в
інтервалі від 298 до 1700 К передається
рівнянням Ср
= 16,78 + 9,04 · 10-3
·
Т - 7,49·105·Т-2.
Обчисліть середню молярну теплоємність
![]() в інтервалі від 300 до 600 К.
в інтервалі від 300 до 600 К.
Розв’язання
Середня молярна теплоємність в інтервалі від Т1 до Т2 дорівнює
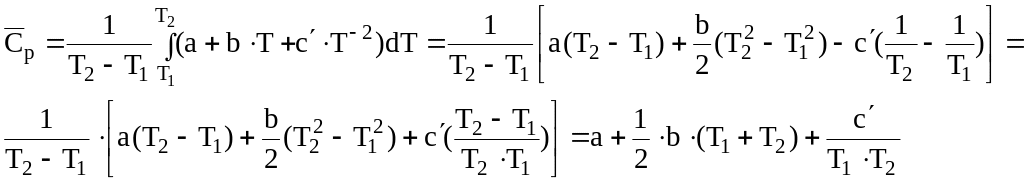
Таким чином, середня молярна теплоємність:
![]()
Експериментальні дані підставляємо до рівняння та отримуємо
![]() .
.
Відповідь: =16,89 Дж/моль К.
Приклад 2.2.2. Азот з вихідними температурою 298 К та тиском 0,05 МПа стискається компресором до 4 МПа. Визначить витрату енергії на стиснення та тепловідвід від компресора при проведенні процесу: а) ізотермічно; б) адіабатично (γ = 1,40).
Розв’язання
При ізотермічному стисненні робота розраховується так:
W = R·T·ln(P1/P2) = 8,314·298·ln(0,05·106/4·106) = -10,9 · 103 Дж/моль,
а теплота дорівнює роботі: Q = W = -10,9 · 103 Дж/моль.
2. При адіабатичному стисненні робота розраховується наступним чином:
![]() .
.
Температуру Т2 азоту наприкінці стиснення визначаємо за рівнянням адіабати:
Т2 = Т1(Р1/Р2)1-γ/γ = 298·(0,05·106/4·106)(1-1,40)/1,40 = 1042 К
Використовуючи отримане значення т2 визначаємо роботу адіабатичного стиснення
![]()
а Q = 0 Дж/моль.
Відповідь: а) Q = W = -10,9 · 103 Дж/моль. б) W = 15,5·103 Дж/моль; Q = 0 Дж/моль
Приклад 2.2.3. Розрахувати зміну ентропії при стандартних умовах для хімічної реакції: 2С4Н10(г.)+5О2 = 4СН3СООН(р.) + 2Н2О(р.). Необхідні дані візьміть в довіднику.
Розв’язання
