
- •1. Вступ
- •1.1. Предмет і мета дисципліни "Фізична хімія"
- •1.4. Тематичний план та зміст лекційного курсу 6 тетраместру
- •1.5. Індивідуальні та домашні завдання для самостійної роботи студентів
- •2. Розрахункові завдання
- •2.1. Основні поняття хімічної термодинаміки
- •2.1.1. Основні визначення
- •2.1.2. Перший закон термодинаміки
- •2.1.3. Закон Геса
- •2.1.4. Теплоємність
- •2.1.5. Закон Кірхгофа
- •2.1.6. Другий закон термодинаміки
- •2.1.7. Постулат Планка
- •2.1.8. Термодинамічні потенціали
- •2.1.9. Рівняння Гібса-Гельмгольца
- •2.1.10. Хімічний потенціал.
- •2.1.11. Хімічна рівновага. Стандартна і емпіричні константи рівноваги.
- •2.1.12. Рівняння ізотерми хімічної реакції Вант-Гофа
- •2.1.13. Рівняння ізобари і ізохори хімічної реакції. Вплив температури, тиску і домішок інертних газів на рівновагу реакції.
- •2.1.14. Обчислення констант рівноваги із стандартних величин термодинамічних функцій за рівнянням Тьомкіна – Шварцмана.
- •2.2. Приклади розв'язання задач
- •2. При адіабатичному стисненні робота розраховується наступним чином:
- •Використовуючи отримане значення т2 визначаємо роботу адіабатичного стиснення
- •Визначаємо зміну ентропії для реакції при стандартних умовах (величини ентропій вихідних речовин та продуктів реакції відповідно даних з довідника):
- •Рівноважна 3-3/4·х 1-1/4·х х Константа рівноваги має такий вираз
- •Прореагувало і утворилося 3х х 4х
- •Тоді, константа рівноваги Кn складає:
- •Якщо тепловий ефект δн не залежить від температури, тоді тепловий ефект хімічної реакції визначаємо за наближеною формою рівняння ізобари:
- •2.3. Багатоваріантні задачі
- •3. Индивідуальне розрахунково-графічне завдання
- •3.1. Пояснення для вирішення завдання
- •3.1.1. Розрахунок константи рівноваги хімічної реакції
- •3.1.2 Розрахунки виходу продуктів реакції
- •3.1.3. Розрахунок залежності виходу аміаку від тиску та температури
- •3.1.4. Розрахунки рівноваги в реальних системах
- •3.2. Багатоваріантне графічно-розрахункове завдання
- •4. Перелік контрольних запитань
- •4.1. Перелік запитань для самоконтролю
- •4.2. Питання до екзаменаційних білетів
- •4.2.1. Теплоємність, перше начало термодинаміки, термохімія
- •4.2.2. Друге і третє начало термодинаміки
- •4.2.3. Хімічна рівновага
- •5. Нарахування рейтингових балів
- •5.1. Таблиця відповідності рейтингових балів за національною та європейською шкалами
- •5.2. Правила нарахування рейтингових балів
- •5.3. Таблиця відповідності оцінок та балів за європейською і національною шкалами
- •6. Список рекомендованої літератури Основна література
- •Перелік позначень
2.1.5. Закон Кірхгофа
Закон
Кірхгофа
формулюється таким чином: температурний
коефіцієнт теплового ефекту хімічної
реакції (![]() або
або
![]() )
дорівнює зміні теплоємності в результаті
перебігу реакції:
)
дорівнює зміні теплоємності в результаті
перебігу реакції:
![]() .
.
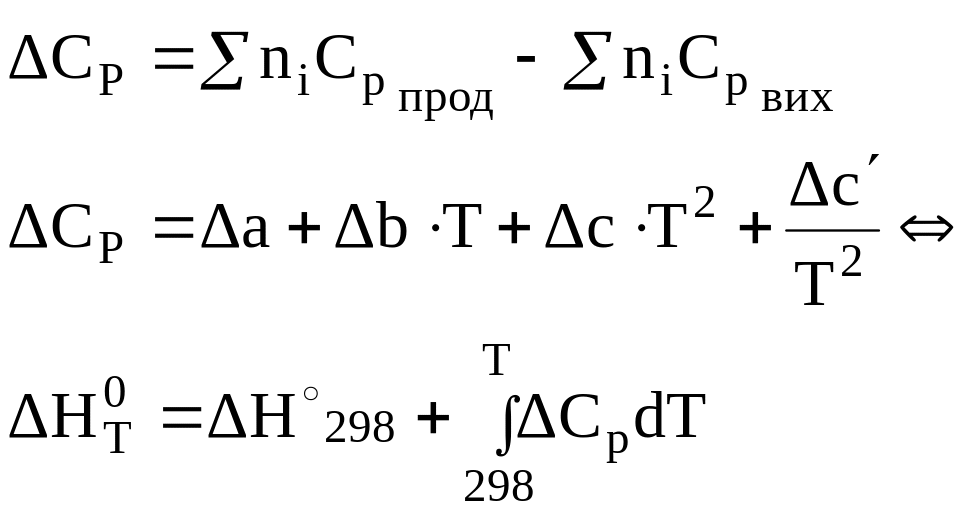
Тоді рівняння Кірхгофа для розрахунку теплового ефекту реакції при нестандартній температурі в інтегральній формі має такий вигляд:
![]()
2.1.6. Другий закон термодинаміки
Формулювання другого закону термодинаміки:
Теплота не може довільно переходити від холодного тіла до гарячого (Клаузіус).
Неможливий періодичний процес, єдиним результатом якого є перетворення теплоти в роботу (Кельвін-Планк).
Існує деяка екстенсивна властивість системи (S), яка носить назву ентропії і зміна якої в рівноважному ізотермічному процесі пов'язана з теплотою і температурою таким чином:
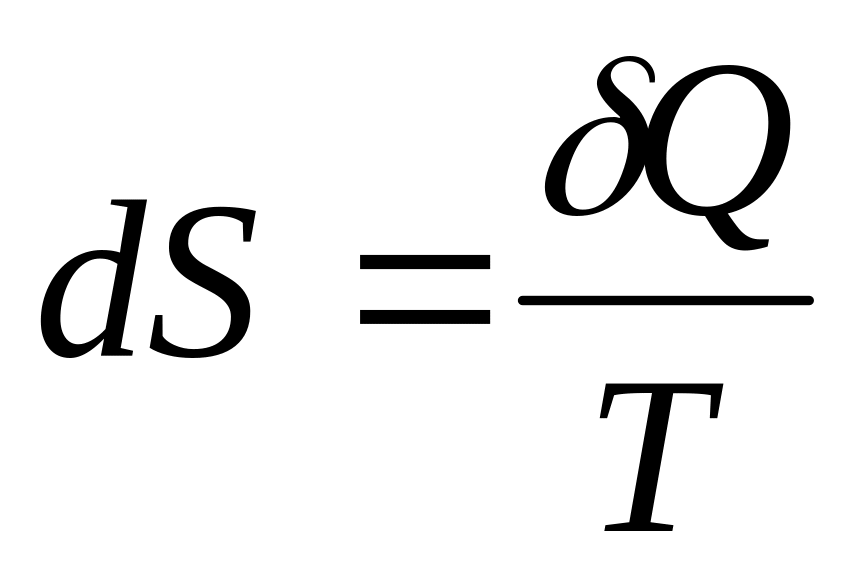 або
або
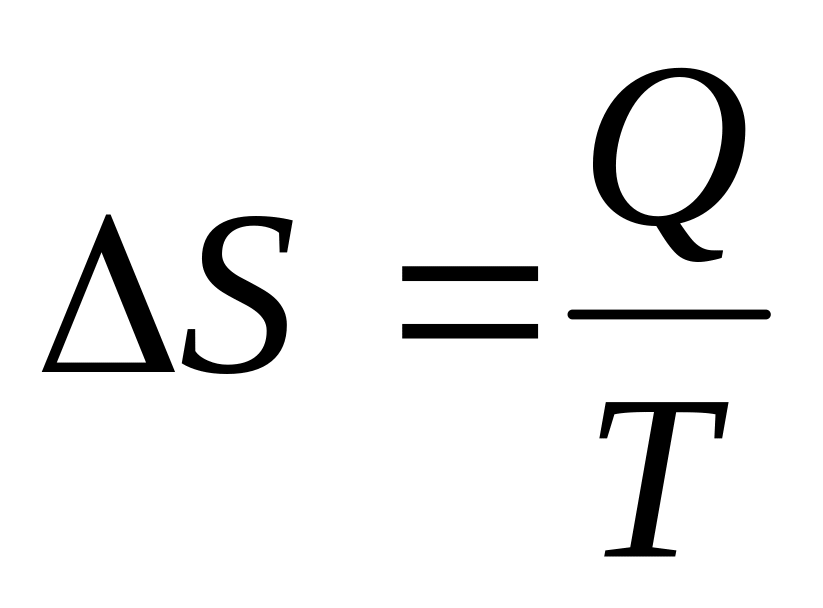 .
.
Аналітичний
вираз другого закону термодинаміки:
![]()
де знак рівності відповідає оборотним, а знак нерівності – необоротним процесам.
Довільний процес – процес, який не потребує витрати енергії зовні.
Рівновага – стан системи, який лишається незмінним в часі і не підтримується яким-небудь зовнішнім процесом по відношенню до системи.
Рівноважний процес – це процес, який відбувається нескінченно повільно і через безперервний ряд станів, близьких до рівноважного.
Реальні процеси є нерівноважними.
Квазістатичний процес – гранично уповільнений процес.
Ентропія
є
критерієм спрямованості процесу в
ізольованій системі: будь-який довільний
процес в ізольованій системі перебігає
в бік збільшення ентропії, а рівновазі
відповідає найбільше її значення:
![]()
Розрахунки ентропії в різних процесах:
Фазові переходи:
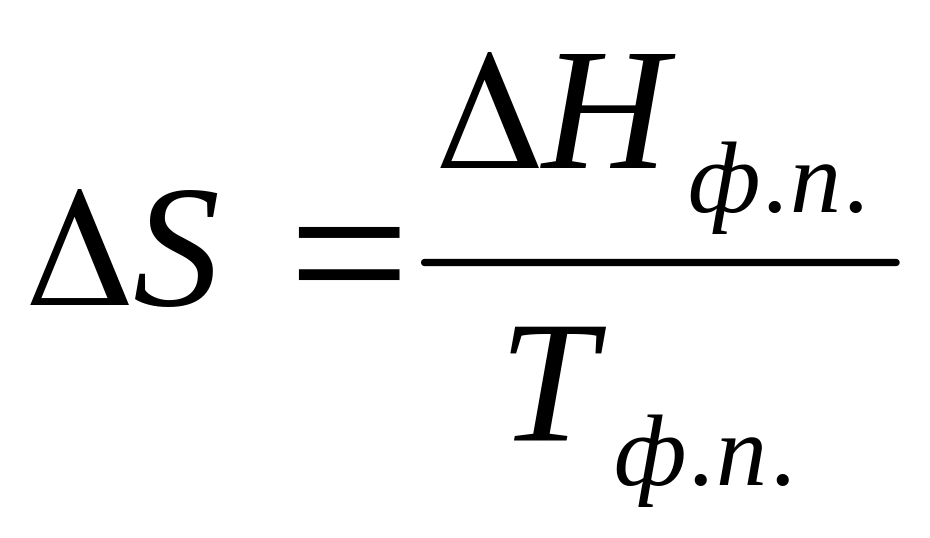 :
:Зміна S одного моля ідеального газу при нагріванні системи:
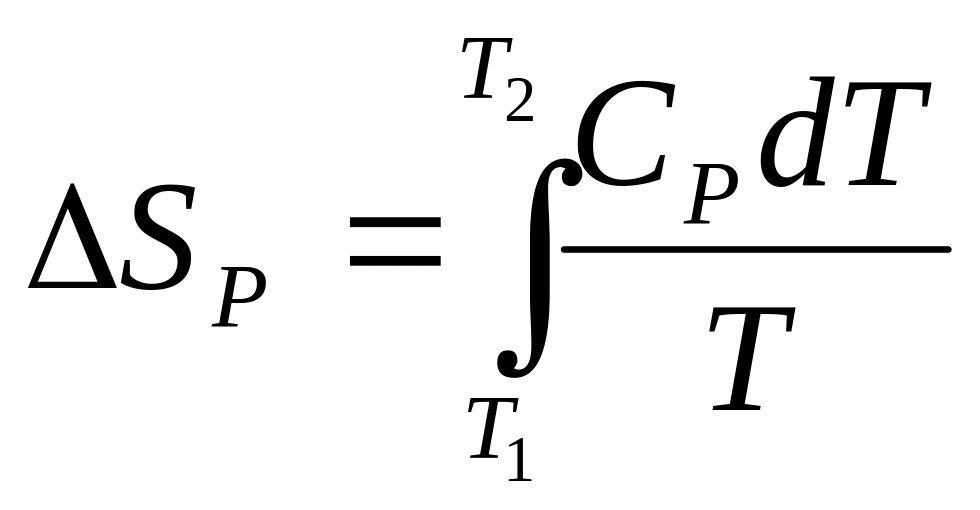 або
або
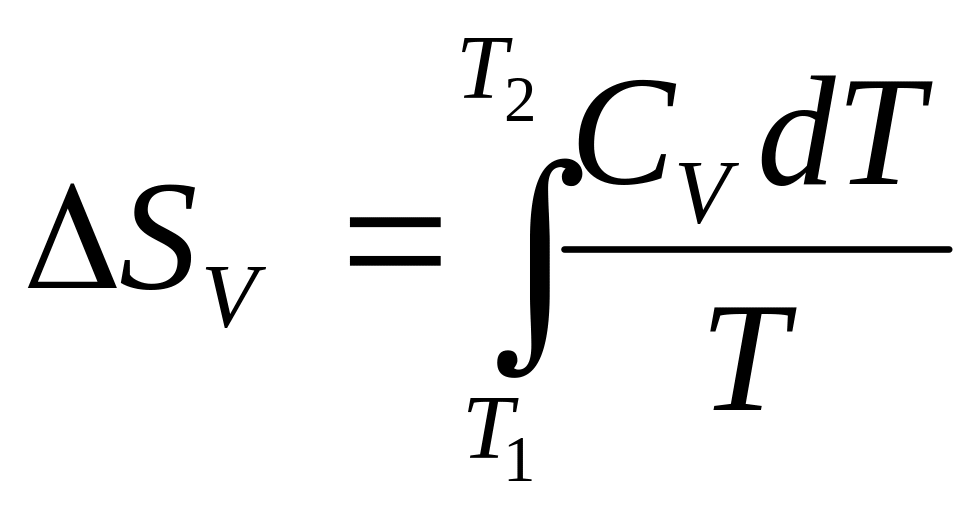
Зміна S одного моля ідеального газу при переходах із стану з Т1 і Р1 до Т2 і Р2.
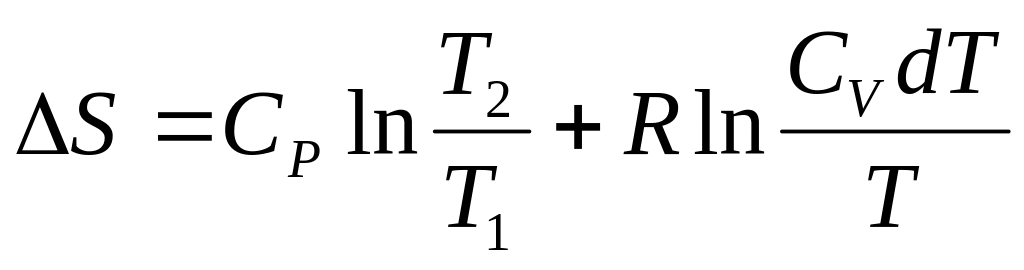 .
.Зміна S одного моля при змішуванні ідеальних газів:
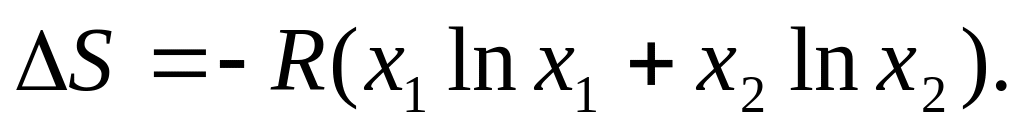 хі-
мольна доля і-ої речовини, яка дорівнює
хі-
мольна доля і-ої речовини, яка дорівнює
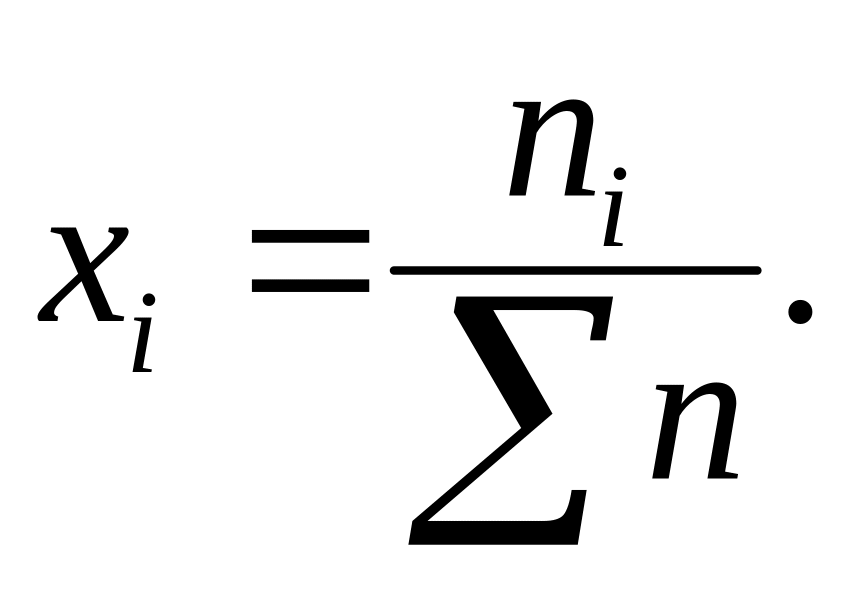
2.1.7. Постулат Планка
Постулат Планка – ентропія ідеальних кристалів при 0 К дорівнює нулю (третій закон термодинаміки).
Абсолютне значення ентропії одного моля будь-якої речовини при заданій температурі Т можна визначити за наступним рівнянням:
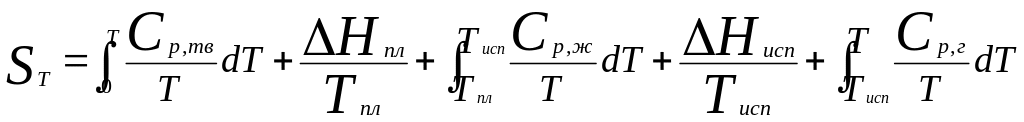
де ΔНпл. - теплота плавлення; ΔНвипар. - теплота випаровування речовини; Тпл., Твипар. – температури фазових переходів; Ср.тв., Ср.рід.., Ср.г. – молярні теплоємності відповідно твердої, рідинної та газової фаз.
2.1.8. Термодинамічні потенціали
Термодинамічним критерієм перебігу довільного процесу є робота, яку здійснює система проти зовнішніх факторів (W).
![]() позначають
корисну
роботу,
тобто роботу, яку здійснює система за
винятком роботи розширення:
позначають
корисну
роботу,
тобто роботу, яку здійснює система за
винятком роботи розширення:
![]()
Для
оборотного процесу:
![]() .
Тоді
.
Тоді
![]() ,
,
![]() ,
а
,
а
![]()
Вираз
об'єднаного першого і другого закону
термодинаміки для
оборотних і необоротних процесів
виглядає так:
![]() ,
де W /
-
корисна робота.
,
де W /
-
корисна робота.
Термодинамічний потенціал – це функція стану системи, величина зміни якої в рівноважному (квазістатистичному) процесі при сталості деяких параметрів дорівнює максимальній корисній роботі. Термодинамічні потенціали слугують критеріями спрямованості процесів в закритих системах.
Критеріями спрямованості процесу можуть бути внутрішня енергія (U), ентальпія (H), енергія Гібса (G) та енергія Гельмгольца (F) в залежності від фізичних параметрів:
В умовах, коли V,S=const, тоді
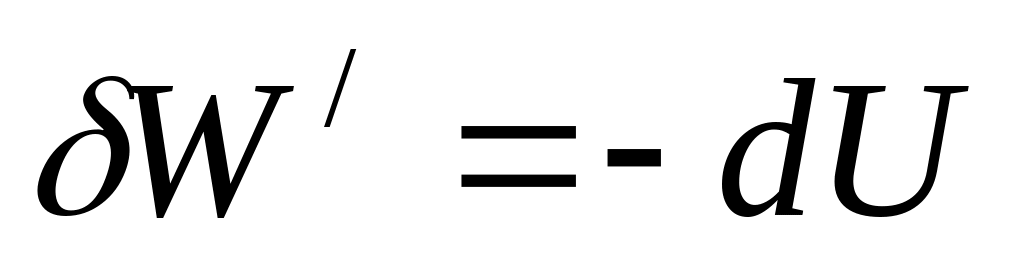 ,
,
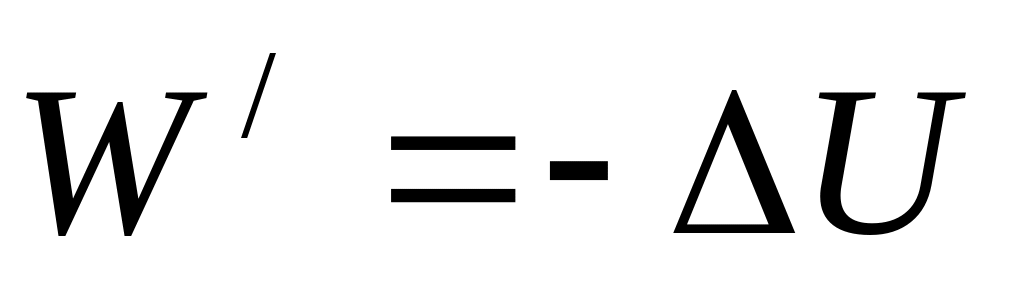 .
.
Якщо
![]() ,
то процес відбувається довільно.
,
то процес відбувається довільно.
Якщо
![]() ,
то процес може відбуватися тільки
примусово.
,
то процес може відбуватися тільки
примусово.
В умовах, коли Р, S=const, тоді
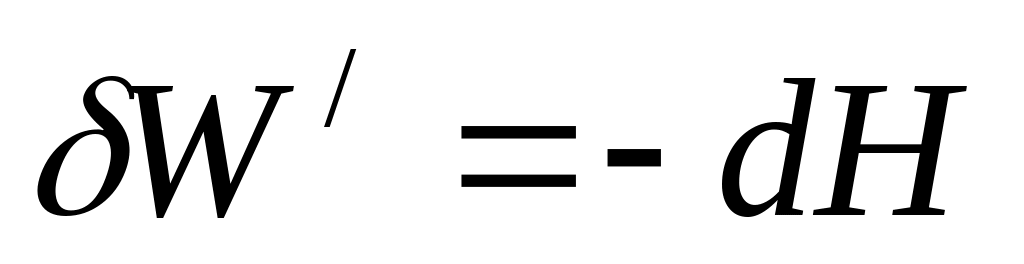 ,
,
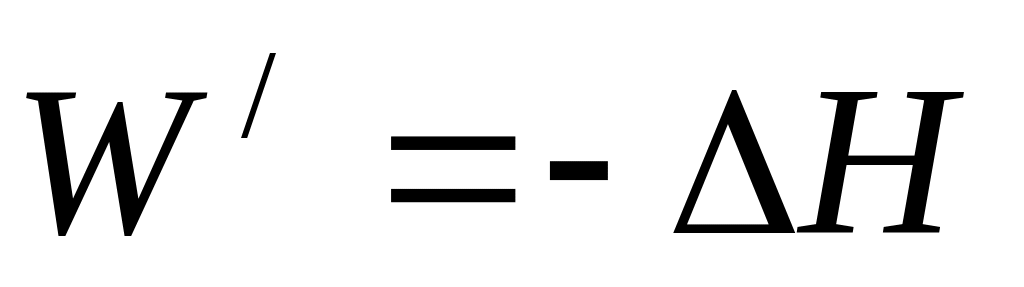 .
.
Якщо
![]() ,
то процес відбувається довільно.
,
то процес відбувається довільно.
Якщо
![]() ,
то процес може відбуватися тільки
примусово.
,
то процес може відбуватися тільки
примусово.
В умовах, коли V,Т=const,
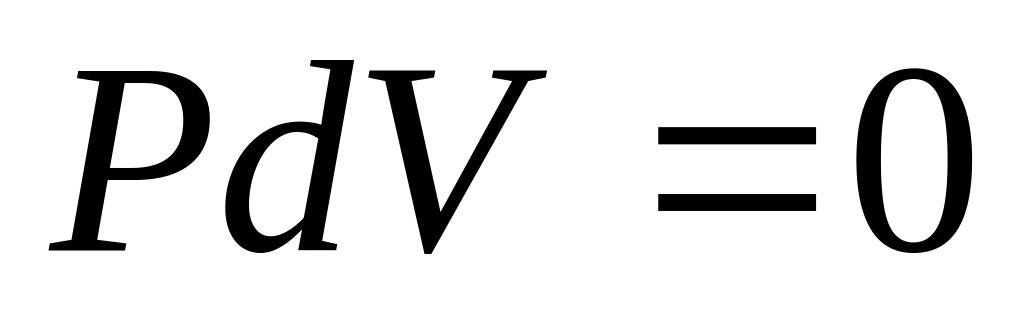 ,
тому
,
тому
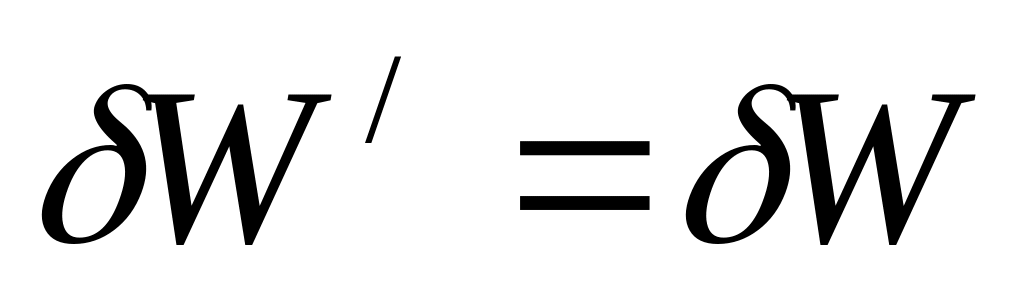 ,
тоді
,
тоді
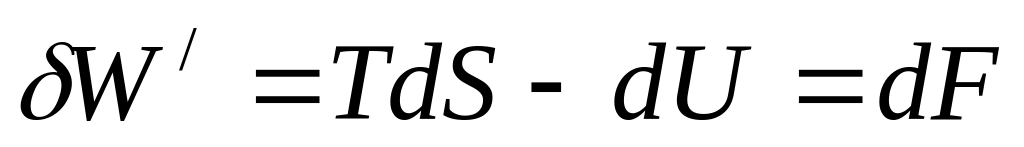 ,
в інтегральному вигляді:
,
в інтегральному вигляді:
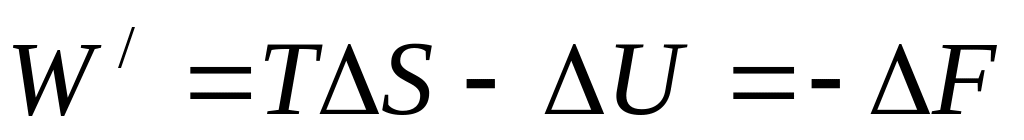 ,
,
де
F (енергія
Гельмгольца) – ізохорно-ізотермічний
потенціал, який визначається таким
чином:
![]() .
.
Якщо
![]() ,
то процес відбувається довільно.
,
то процес відбувається довільно.
Якщо
![]() ,
то процес може відбуватися тільки
примусово.
,
то процес може відбуватися тільки
примусово.
В умовах, коли Р,Т=const, і
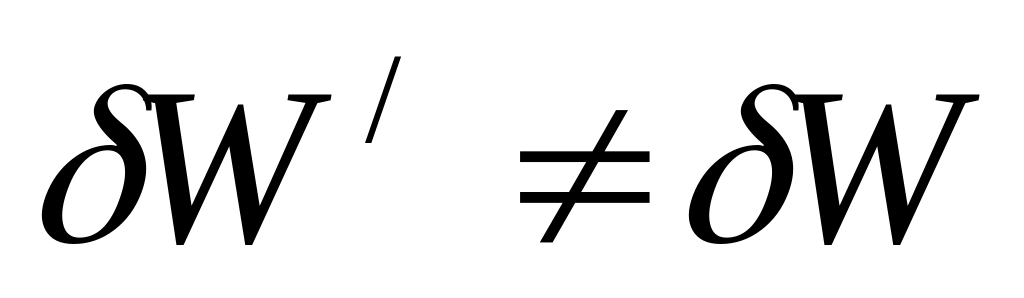 ,
тоді
,
тоді
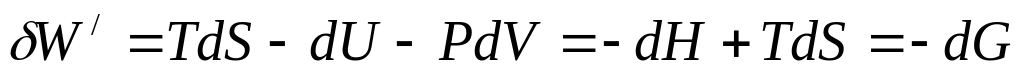 .
В інтегральному вигляді:
.
В інтегральному вигляді:
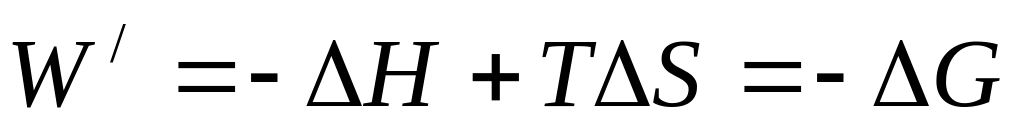 ,
,
де
G
(енергія Гібса)-
ізобарно-ізотермічний потенціал, який
визначається наступним чином :
![]() .
.
Якщо
![]() ,
то процес відбувається довільно.
,
то процес відбувається довільно.
Якщо
![]() ,
то процес може відбуватися тільки
примусово.
,
то процес може відбуватися тільки
примусово.
При довільному перебігу будь-якого фізико-хімічного або хімічного процесу в закритій системі термодинамічні потенціали при сталості відповідних параметрів системи повинні зменшуватися. При достиганні рівноваги в системі термодинамічні потенціали досягають мінімального значення.
