
- •1. Вступ
- •1.1. Предмет і мета дисципліни "Фізична хімія"
- •1.4. Тематичний план та зміст лекційного курсу 6 тетраместру
- •1.5. Індивідуальні та домашні завдання для самостійної роботи студентів
- •2. Розрахункові завдання
- •2.1. Основні поняття хімічної термодинаміки
- •2.1.1. Основні визначення
- •2.1.2. Перший закон термодинаміки
- •2.1.3. Закон Геса
- •2.1.4. Теплоємність
- •2.1.5. Закон Кірхгофа
- •2.1.6. Другий закон термодинаміки
- •2.1.7. Постулат Планка
- •2.1.8. Термодинамічні потенціали
- •2.1.9. Рівняння Гібса-Гельмгольца
- •2.1.10. Хімічний потенціал.
- •2.1.11. Хімічна рівновага. Стандартна і емпіричні константи рівноваги.
- •2.1.12. Рівняння ізотерми хімічної реакції Вант-Гофа
- •2.1.13. Рівняння ізобари і ізохори хімічної реакції. Вплив температури, тиску і домішок інертних газів на рівновагу реакції.
- •2.1.14. Обчислення констант рівноваги із стандартних величин термодинамічних функцій за рівнянням Тьомкіна – Шварцмана.
- •2.2. Приклади розв'язання задач
- •2. При адіабатичному стисненні робота розраховується наступним чином:
- •Використовуючи отримане значення т2 визначаємо роботу адіабатичного стиснення
- •Визначаємо зміну ентропії для реакції при стандартних умовах (величини ентропій вихідних речовин та продуктів реакції відповідно даних з довідника):
- •Рівноважна 3-3/4·х 1-1/4·х х Константа рівноваги має такий вираз
- •Прореагувало і утворилося 3х х 4х
- •Тоді, константа рівноваги Кn складає:
- •Якщо тепловий ефект δн не залежить від температури, тоді тепловий ефект хімічної реакції визначаємо за наближеною формою рівняння ізобари:
- •2.3. Багатоваріантні задачі
- •3. Индивідуальне розрахунково-графічне завдання
- •3.1. Пояснення для вирішення завдання
- •3.1.1. Розрахунок константи рівноваги хімічної реакції
- •3.1.2 Розрахунки виходу продуктів реакції
- •3.1.3. Розрахунок залежності виходу аміаку від тиску та температури
- •3.1.4. Розрахунки рівноваги в реальних системах
- •3.2. Багатоваріантне графічно-розрахункове завдання
- •4. Перелік контрольних запитань
- •4.1. Перелік запитань для самоконтролю
- •4.2. Питання до екзаменаційних білетів
- •4.2.1. Теплоємність, перше начало термодинаміки, термохімія
- •4.2.2. Друге і третє начало термодинаміки
- •4.2.3. Хімічна рівновага
- •5. Нарахування рейтингових балів
- •5.1. Таблиця відповідності рейтингових балів за національною та європейською шкалами
- •5.2. Правила нарахування рейтингових балів
- •5.3. Таблиця відповідності оцінок та балів за європейською і національною шкалами
- •6. Список рекомендованої літератури Основна література
- •Перелік позначень
3. Индивідуальне розрахунково-графічне завдання
3.1. Пояснення для вирішення завдання
3.1.1. Розрахунок константи рівноваги хімічної реакції
В основі розрахунку константи рівноваги хімічної реакції:
аА + bB = cC + dD, (3.1)
де a, b, c, d – стехіометричні коефіцієнти; А, B – вихідні компоненти; C, D – продукти реакції (всі речовини в системі газоподібні), полягає рівняння стандартної хімічної спорідненості:
![]() ,
(3.2)
,
(3.2)
де
![]() - зміна енергії Гібса системи в результаті
хімічної реакції при стандартному тиску
(Р0
= 101325
Па);
- зміна енергії Гібса системи в результаті
хімічної реакції при стандартному тиску
(Р0
= 101325
Па);
![]() -
стандартна константа рівноваги:
-
стандартна константа рівноваги:
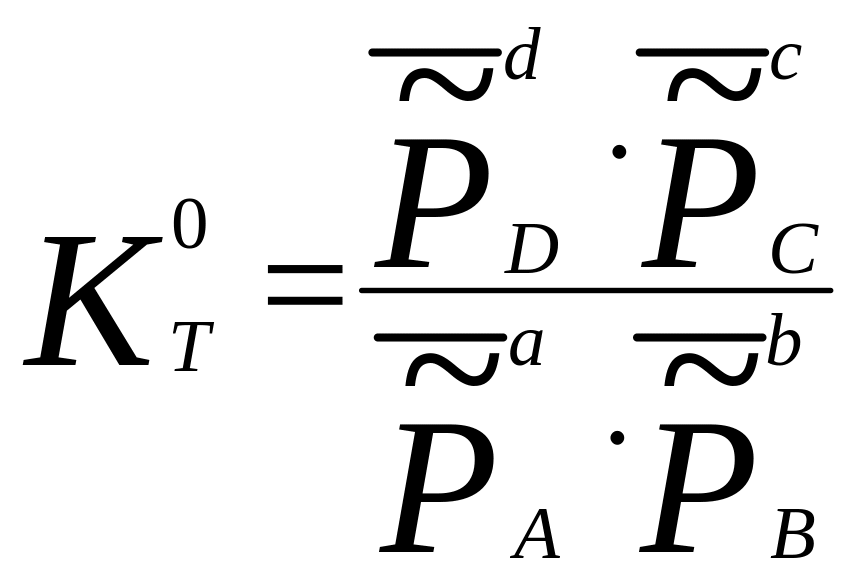 ,
(3.3)
,
(3.3)
де
![]() -
приведений рівноважний тиск, який
визначається через парціальний тиск
(Рі)
відносно стандартного тиску (Р0):
-
приведений рівноважний тиск, який
визначається через парціальний тиск
(Рі)
відносно стандартного тиску (Р0):
![]() .
.
Зміну вільної енергії знаходять за рівнянням Гібса-Гельмгольца:
![]() .
(3.4)
.
(3.4)
Для
цього необхідно знати теплоту реакції
при довільній температурі
![]() та зміну ентропії
та зміну ентропії
![]() .
.
можливо розрахувати за рівнянням Кірхгофа:
![]() ,
(3.5)
,
(3.5)
- за рівнянням:
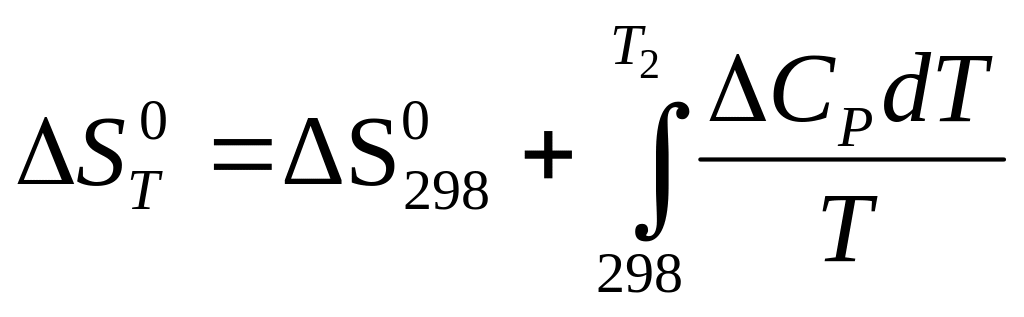 .
(3.6)
.
(3.6)
В
цих рівняннях
![]() ,
,
![]() - стандартні ентальпія та ентропія
реакції при Т = 298 К, їх розраховують із
співвідношень:
- стандартні ентальпія та ентропія
реакції при Т = 298 К, їх розраховують із
співвідношень:
![]() (3.7)
(3.7)
![]() (3.8)
(3.8)
![]() (теплота
утворення) та
(теплота
утворення) та
![]() (абсолютна ентропія) є властивостями
даних речовин та приведені в довіднику;
n, m - відповідно кількість продуктів
реакції та вихідних речовин; ΔCp
-
зміна теплоємності в ході реакції, яке
розраховується за рівнянням:
(абсолютна ентропія) є властивостями
даних речовин та приведені в довіднику;
n, m - відповідно кількість продуктів
реакції та вихідних речовин; ΔCp
-
зміна теплоємності в ході реакції, яке
розраховується за рівнянням:
![]() (3.9).
(3.9).
Теплоємність є функцією від температури, яка виражається у вигляді степеневих рядів:
![]() (органічні
речовини) (3.10)
(органічні
речовини) (3.10)
![]() (неорганічні
речовини)
(неорганічні
речовини)
(коефіцієнти а, b с, с´ приведені в довіднику [6]). Враховуючи ці залежності, можна записати:
![]() (3.11)
(3.11)
де Δа розраховується як:
![]() (3.12).
(3.12).
Інші коефіцієнти (Δb Δс, Δс´), що залежать тільки від природи реагуючих речовин, тотожні.
Відповідно з вищезазначеним:
 (3.13)
(3.13)
або
![]() ,
(3.14)
,
(3.14)
де - функції, що залежать тільки від температури.
Рівняння (3.14) має назву Тьомкіна-Шварцмана. Для температур кратних 100, значення інтегралів для яких були вирахувані Тьомкіним та Шварцманом, приведені в довідниках.
Для інших Т функції розраховуються за рівняннями:
![]() (3.15)
(3.15)
![]() (3.16)
(3.16)
де n – відповідає індексу при М (крім n = 0).
Таким чином, стандартну константу рівноваги можна вирахувати за рівнянням:
![]() (3.17)
(3.17)
3.1.2 Розрахунки виходу продуктів реакції
Для
розрахунку виходу продуктів реакції
необхідно знати чисельний вираз
термодинамічної константи рівноваги
![]() ,
константи рівноваги, що виражена через
рівноважне число молей реагуючих речовин
,
константи рівноваги, що виражена через
рівноважне число молей реагуючих речовин
![]() ,
загальний тиск
,
загальний тиск
![]() ,
зміну числа молей реагуючих газоподібних
речовин в ході реакції
,
зміну числа молей реагуючих газоподібних
речовин в ході реакції
![]() та суму числа молей в рівноважному стані
та суму числа молей в рівноважному стані
![]() :
:
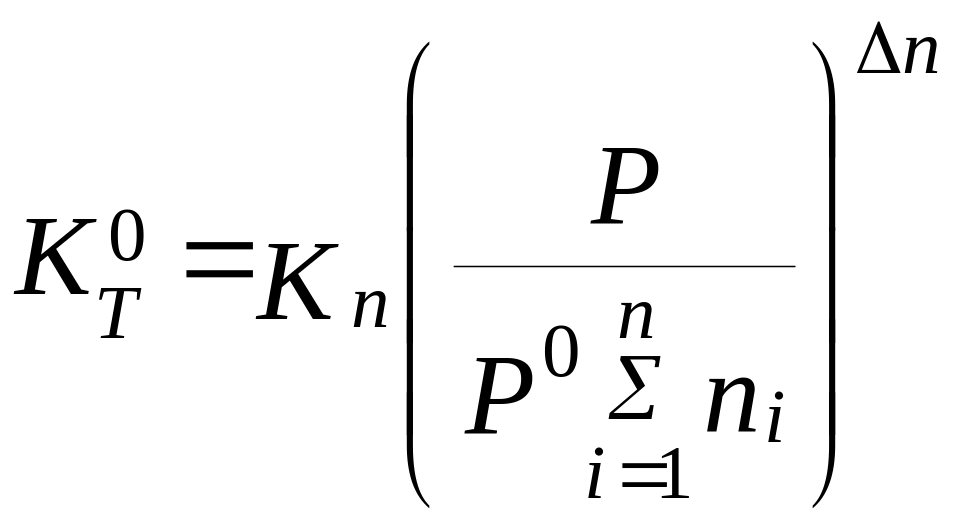 (3.18)
(3.18)
Розглянемо
приклад рівнянь для розрахунків
![]() ,
,
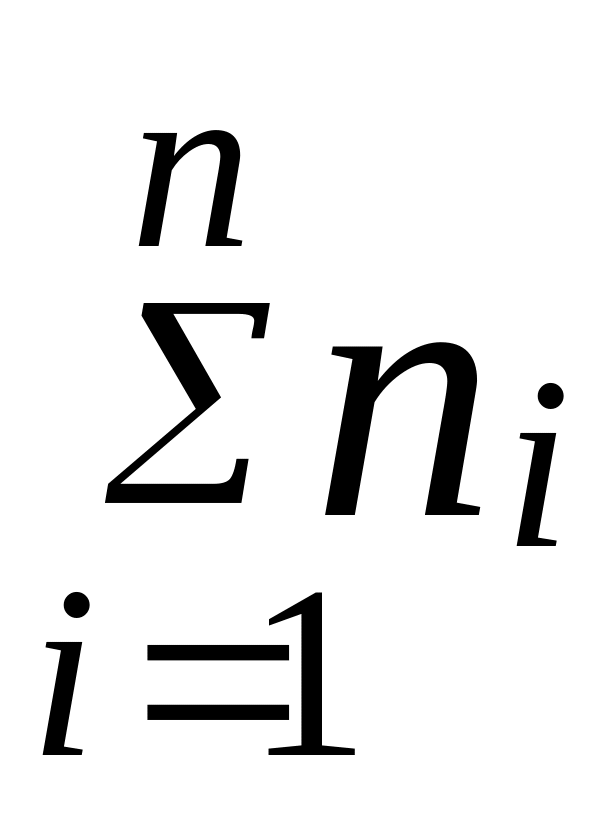 та
та
![]() коли початковий вміст вихідних речовин
чисельно дорівнює стехіометричним
коефіцієнтам, а через невідоме х
позначається вихід продукту реакції в
процентах (долях) до моменту рівноваги.
коли початковий вміст вихідних речовин
чисельно дорівнює стехіометричним
коефіцієнтам, а через невідоме х
позначається вихід продукту реакції в
процентах (долях) до моменту рівноваги.
Реакція: |
аА |
+ |
bB |
= |
cC |
+ |
dD |
Вихідний вміст речовин (t=0) |
а |
|
b |
|
- |
|
- |
До моменту встановлення рівноваги прореагувало та утворилось |
a·x |
|
b·x |
|
c·x |
|
d·x |
Рівноважний вміст |
a(1-x) |
|
b(1-x) |
|
c·x |
|
d·x |
Підставив у вираз для константи рівноваги число молей кожної речовини, що складають рівноважну суміш, після деяких перетворень отримаємо:
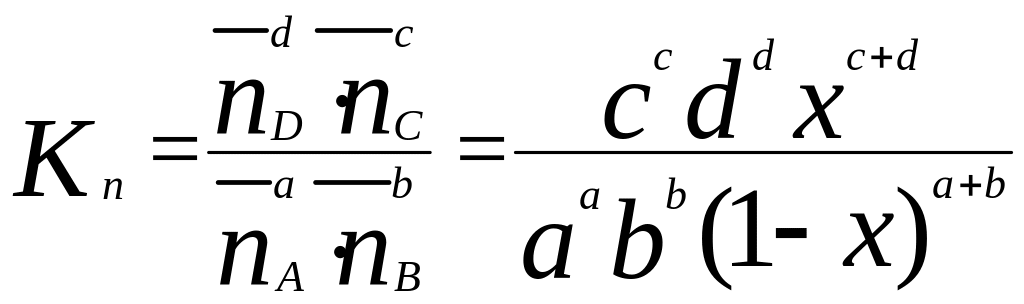 (3.19)
(3.19)
де
![]() - рівноважний вміст і-го компоненту: Х
– доля речовини, що прореагувала (вихід
продукту в долях одиниці).
- рівноважний вміст і-го компоненту: Х
– доля речовини, що прореагувала (вихід
продукту в долях одиниці).
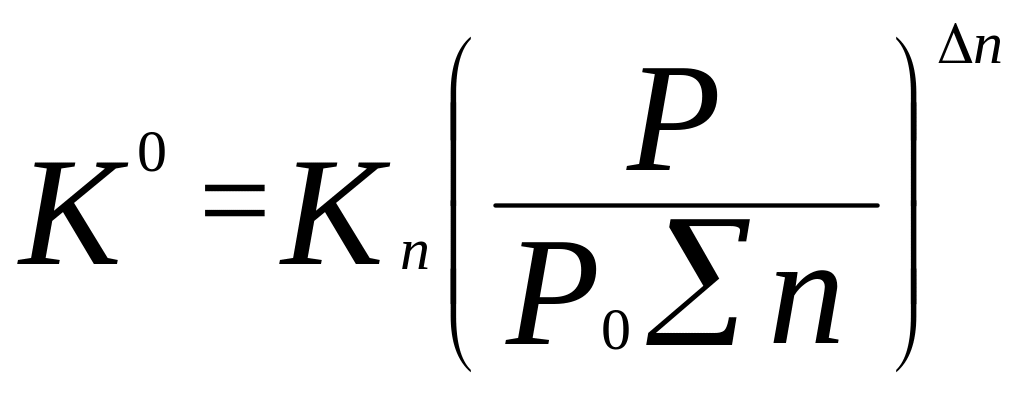 ;
;![]() ;
;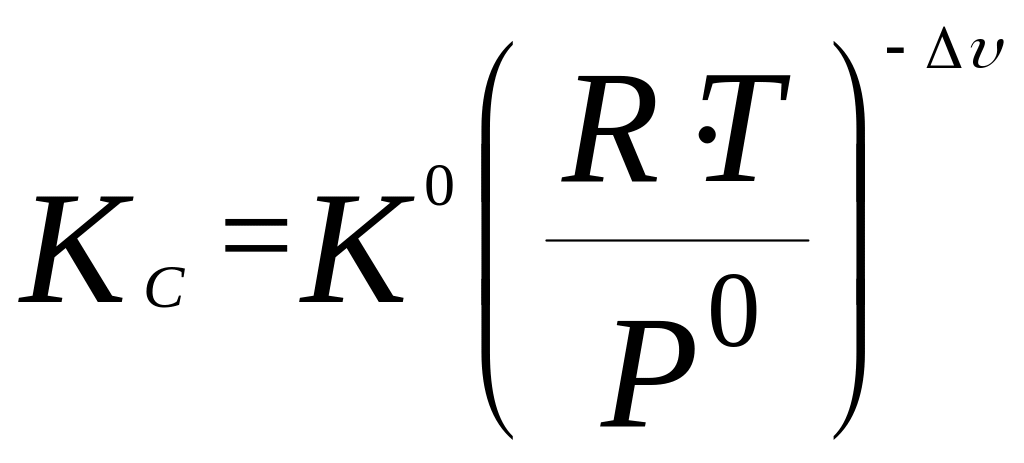 ;
;
![]() (3.20)
(3.20)
![]() ,
(3.21)
,
(3.21)
де
![]() (3.22)
(3.22)
Якщо
рівняння (3.19) має ступінь вищий за другу,
доля х речовини, що прореагувала до
моменту рівноваги, розраховується одним
з ітераційних методів. Тут використовується
метод половинного ділення, який полягає
в тому, що при кожній ітерації
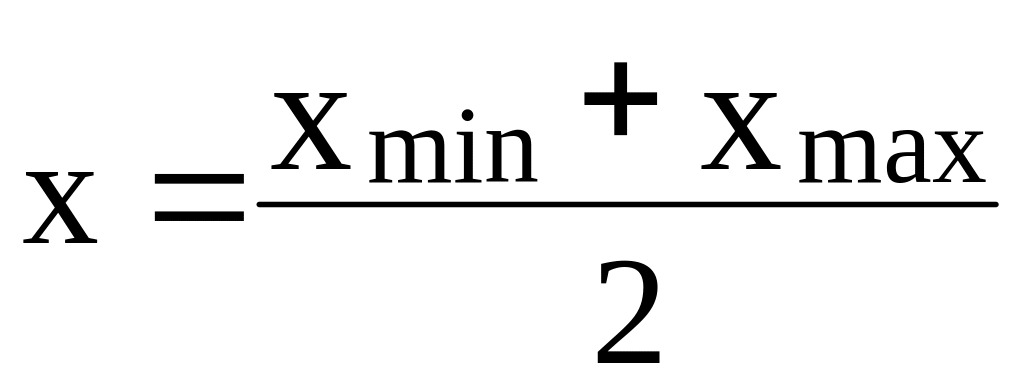 (хmin
та xmax–
межі пошуку виходу x
продукту). При цьому, якщо
(хmin
та xmax–
межі пошуку виходу x
продукту). При цьому, якщо
![]() то
то
![]() присвоюється
значення x,
якщо
присвоюється
значення x,
якщо
![]() то
то
![]() .
.
Пошук значення x, що задовольняє нерівності
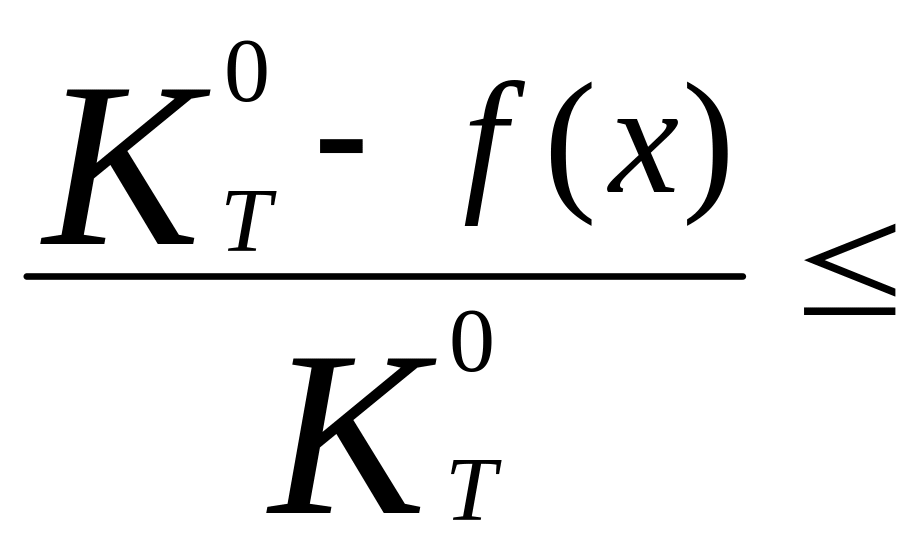
![]() (3.23)
(3.23)
де
–
межа мінімізації,
![]() - права частина рівняння (3.18), що
відбувається в інтервалі
- права частина рівняння (3.18), що
відбувається в інтервалі
![]() .
При цьому збіжність ряду визначається
за нерівністю:
.
При цьому збіжність ряду визначається
за нерівністю:
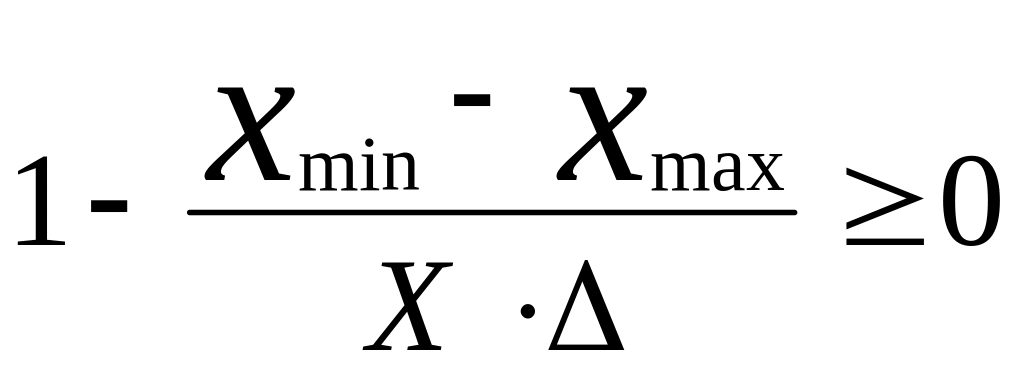 ,
(3.24)
,
(3.24)
де
![]() –
відповідно верхня та нижня межа інтервалу
пошуку; Δ - задана погрішність розрахунку,
що приймається звичайно 0,01 (1%). Початкові
межі пошуку: xmin
= 0, xmax
= 1.
–
відповідно верхня та нижня межа інтервалу
пошуку; Δ - задана погрішність розрахунку,
що приймається звичайно 0,01 (1%). Початкові
межі пошуку: xmin
= 0, xmax
= 1.
