
- •1. Вступ
- •1.1. Предмет і мета дисципліни "Фізична хімія"
- •1.4. Тематичний план та зміст лекційного курсу 6 тетраместру
- •1.5. Індивідуальні та домашні завдання для самостійної роботи студентів
- •2. Розрахункові завдання
- •2.1. Основні поняття хімічної термодинаміки
- •2.1.1. Основні визначення
- •2.1.2. Перший закон термодинаміки
- •2.1.3. Закон Геса
- •2.1.4. Теплоємність
- •2.1.5. Закон Кірхгофа
- •2.1.6. Другий закон термодинаміки
- •2.1.7. Постулат Планка
- •2.1.8. Термодинамічні потенціали
- •2.1.9. Рівняння Гібса-Гельмгольца
- •2.1.10. Хімічний потенціал.
- •2.1.11. Хімічна рівновага. Стандартна і емпіричні константи рівноваги.
- •2.1.12. Рівняння ізотерми хімічної реакції Вант-Гофа
- •2.1.13. Рівняння ізобари і ізохори хімічної реакції. Вплив температури, тиску і домішок інертних газів на рівновагу реакції.
- •2.1.14. Обчислення констант рівноваги із стандартних величин термодинамічних функцій за рівнянням Тьомкіна – Шварцмана.
- •2.2. Приклади розв'язання задач
- •2. При адіабатичному стисненні робота розраховується наступним чином:
- •Використовуючи отримане значення т2 визначаємо роботу адіабатичного стиснення
- •Визначаємо зміну ентропії для реакції при стандартних умовах (величини ентропій вихідних речовин та продуктів реакції відповідно даних з довідника):
- •Рівноважна 3-3/4·х 1-1/4·х х Константа рівноваги має такий вираз
- •Прореагувало і утворилося 3х х 4х
- •Тоді, константа рівноваги Кn складає:
- •Якщо тепловий ефект δн не залежить від температури, тоді тепловий ефект хімічної реакції визначаємо за наближеною формою рівняння ізобари:
- •2.3. Багатоваріантні задачі
- •3. Индивідуальне розрахунково-графічне завдання
- •3.1. Пояснення для вирішення завдання
- •3.1.1. Розрахунок константи рівноваги хімічної реакції
- •3.1.2 Розрахунки виходу продуктів реакції
- •3.1.3. Розрахунок залежності виходу аміаку від тиску та температури
- •3.1.4. Розрахунки рівноваги в реальних системах
- •3.2. Багатоваріантне графічно-розрахункове завдання
- •4. Перелік контрольних запитань
- •4.1. Перелік запитань для самоконтролю
- •4.2. Питання до екзаменаційних білетів
- •4.2.1. Теплоємність, перше начало термодинаміки, термохімія
- •4.2.2. Друге і третє начало термодинаміки
- •4.2.3. Хімічна рівновага
- •5. Нарахування рейтингових балів
- •5.1. Таблиця відповідності рейтингових балів за національною та європейською шкалами
- •5.2. Правила нарахування рейтингових балів
- •5.3. Таблиця відповідності оцінок та балів за європейською і національною шкалами
- •6. Список рекомендованої літератури Основна література
- •Перелік позначень
2.1.9. Рівняння Гібса-Гельмгольца
Рівняння Гібса-Гельмгольца має такий вигляд:
![]() для
ізохорно-ізотермічних процесів
для
ізохорно-ізотермічних процесів
![]() для
ізобарно-ізотермічних процесів,
для
ізобарно-ізотермічних процесів,
де
![]() -
зв'язана енергія або зв'язана теплота,
тобто та частина енергії, яка не може
бути перетворена в роботу.
-
зв'язана енергія або зв'язана теплота,
тобто та частина енергії, яка не може
бути перетворена в роботу.
Характеристичні функції – це функції стану системи, за допомогою яких та їх похідних різноманітних порядків за відповідними параметрами можуть бути виражені в явному вигляді всі термодинамічні властивості системи. {характеристичними функціями можуть бути U, H, F , G , а також T, S та V.
2.1.10. Хімічний потенціал.
Хімічний потенціал (μ) і-ої речовини дорівнює зміні енергії Гібса при додаванні 1 молю цієї речовини в умовах сталості температури и тиску до такої великої кількості реакційної суміші, що склад її практично не змінюється:
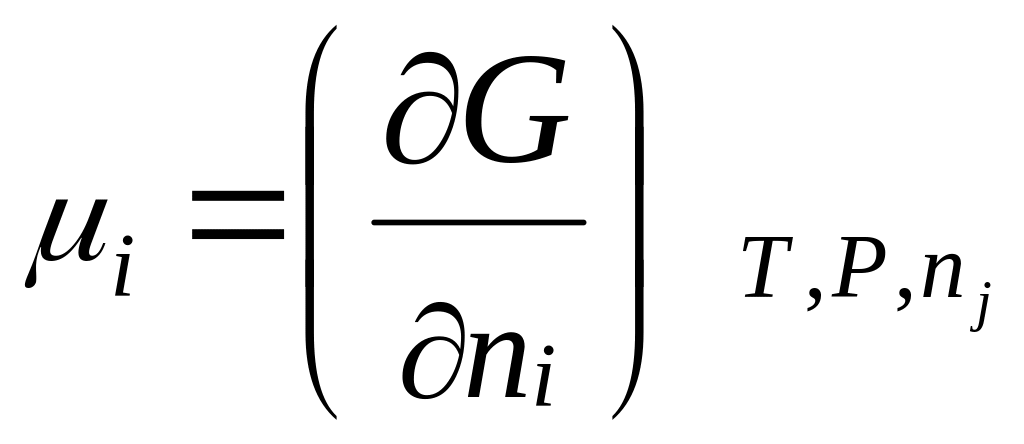
Хімічний потенціал є інтенсивною величиною:
![]() ,
або
,
або
![]() .
.
Хімічний потенціал використовується для опису відкритих багатокомпонентних систем, маси яких можуть бути несталими внаслідок хімічних реакцій, процесів випаровування, кристалізації і т. ін. В залежності від умов:
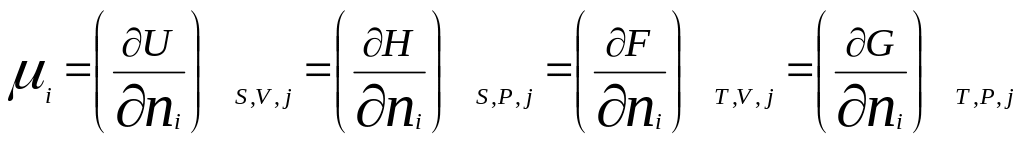 .
.
Для
1 моля однокомпонентної системи однофазної
системи хімічний потенціал дорівнює
термодинамічному потенціалу 1 моля
чистої речовини:
![]() .
.
Хімічний потенціал є критерієм спрямованості процесів у відкритих системах:
умови
рівновага
-
![]() ,
,
![]() ;
;
умови
довільності процесу -
![]() .
.
Речовина
може довільно переходити з фази, де його
хімічний потенціал вище, в фазу, де його
хімічний потенціал нижче. Умови рівноваги:
![]() .
.
Значення
хімічного потенціалу можна розрахувати
через тиск, концентрацію або активність
речовини:
![]() ,
,
![]() або
або
![]() ,
де
,
де
![]() -
стандартний хімічний потенціал.
-
стандартний хімічний потенціал.
2.1.11. Хімічна рівновага. Стандартна і емпіричні константи рівноваги.
Хімічна рівновага – такий стан хімічної реакції, в якому виконуються наступні умови:
а) швидкість прямої та оборотної реакцій однакові (динамічна рівновага);
б)
![]() при сталих Т, Р або
при сталих Т, Р або
![]() при сталих Т, V (термодинамічна рівновага).
при сталих Т, V (термодинамічна рівновага).
За законом діючих мас стандартна константа рівноваги (К0) чисельно позначується через приведені рівноважні тиски вихідних речовин та продуктів реакції.
Для реакції aA + bB = dD + cC К0 має наступний вигляд:
![]()
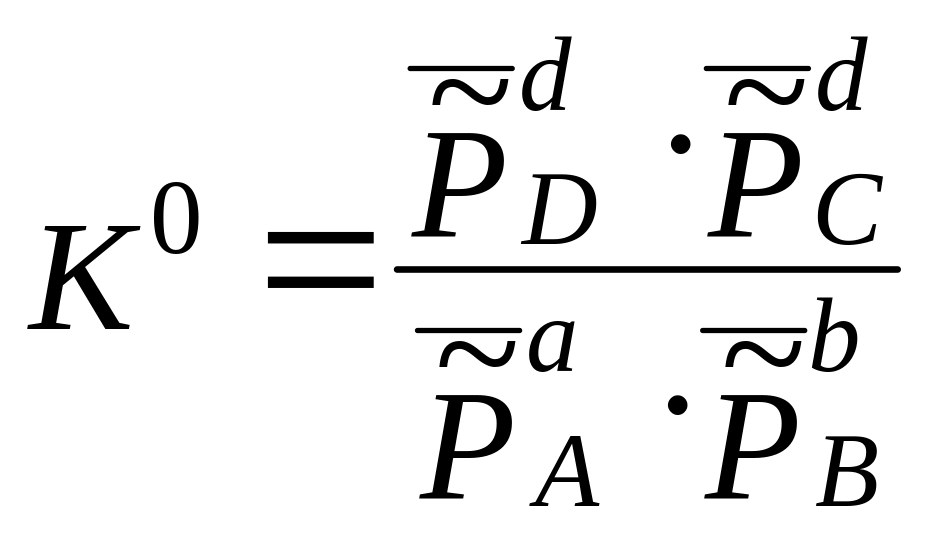 ,
,
де
![]() -
приведений рівноважний тиск, який
визначається через парціальний тиск
(Рі)
відносно стандартного тиску (Р0),
який дорівнює 101325 Па:
-
приведений рівноважний тиск, який
визначається через парціальний тиск
(Рі)
відносно стандартного тиску (Р0),
який дорівнює 101325 Па:
![]() .
.
На практиці для опису хімічних рівноваг використовують емпіричні константи рівноваги (Kp, Kc, Kn, Kx):
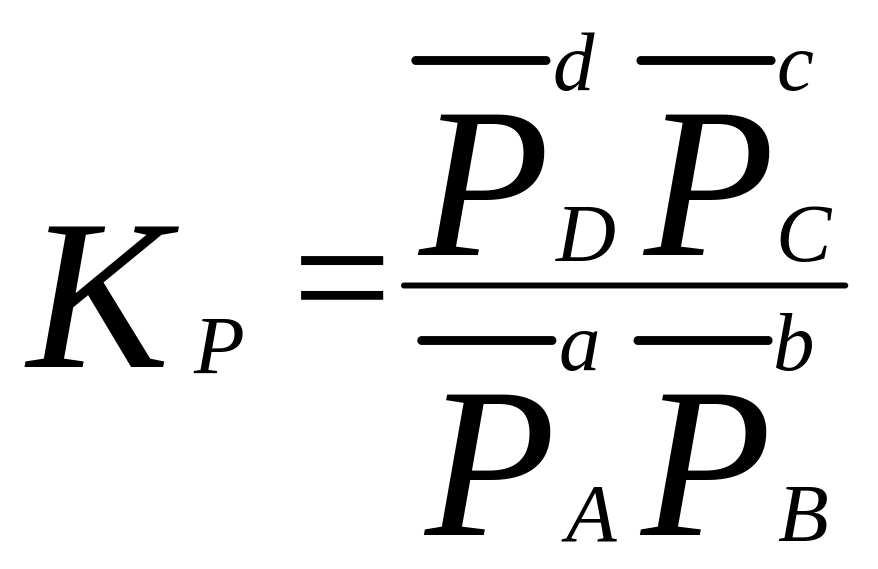 ;
;
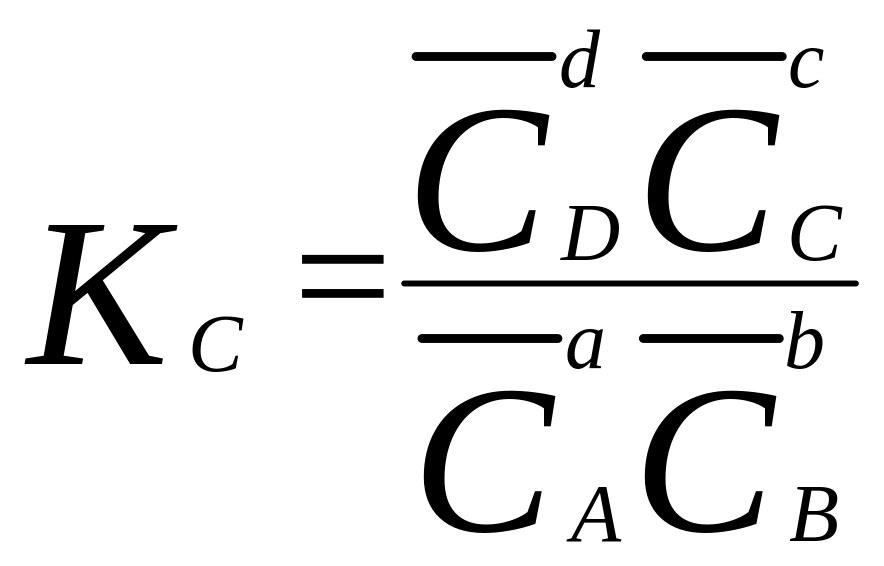 ;
;
 ;
;
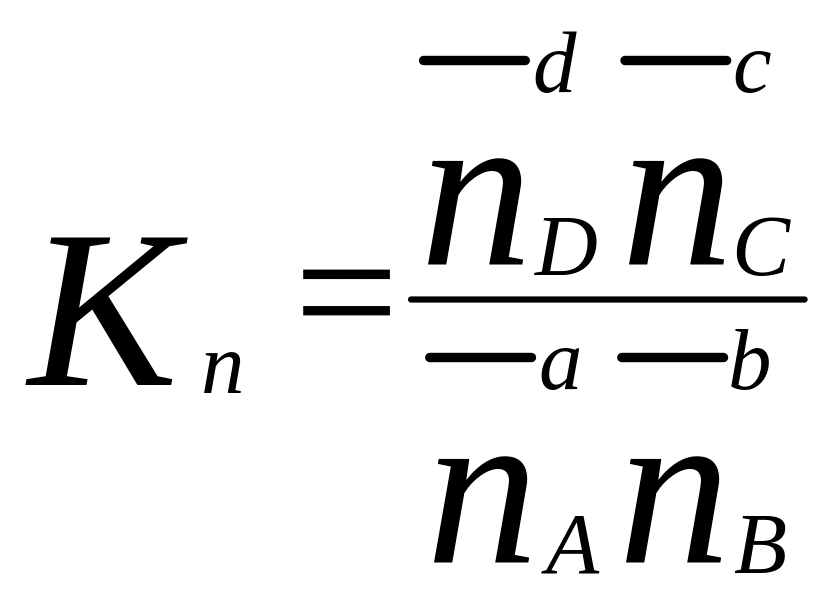 ,
,
де
![]() - рівноважні парціальні тиски, рівноважні
концентрації, рівноважні мольні долі
та рівноважні числа молей відповідно.
Виходячи з цього розмірність констант
визначається таким чином:
- рівноважні парціальні тиски, рівноважні
концентрації, рівноважні мольні долі
та рівноважні числа молей відповідно.
Виходячи з цього розмірність констант
визначається таким чином:![]() ;
;
![]() ;
;
![]() ,
,
![]() -
різниця між сумою стехіометричних
коефіцієнтів при газоподібних продуктах
та сумою стехіометричних коефіцієнтів
при газоподібних вихідних речовинах.
-
різниця між сумою стехіометричних
коефіцієнтів при газоподібних продуктах
та сумою стехіометричних коефіцієнтів
при газоподібних вихідних речовинах.
Між константами рівноваги існує такий зв’язок:
![]() ;
;
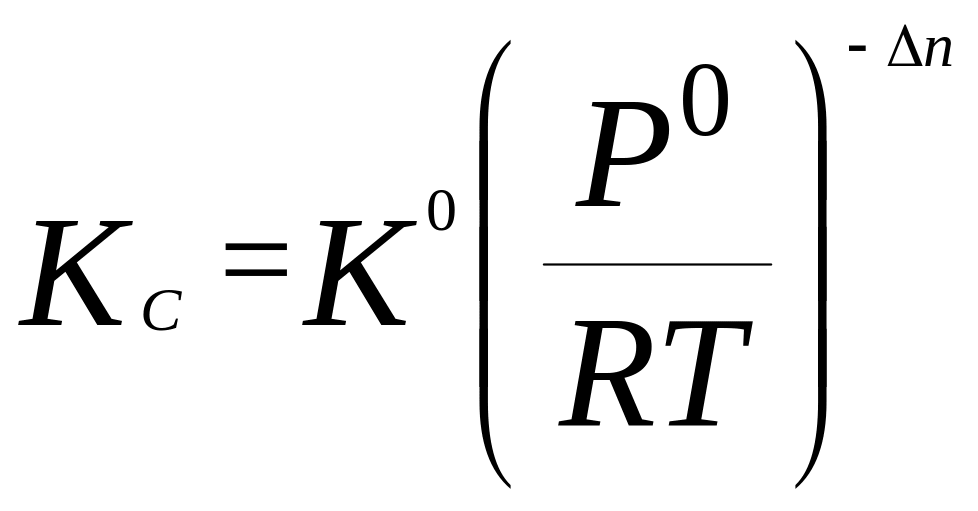 ;
;
![]() ;
;
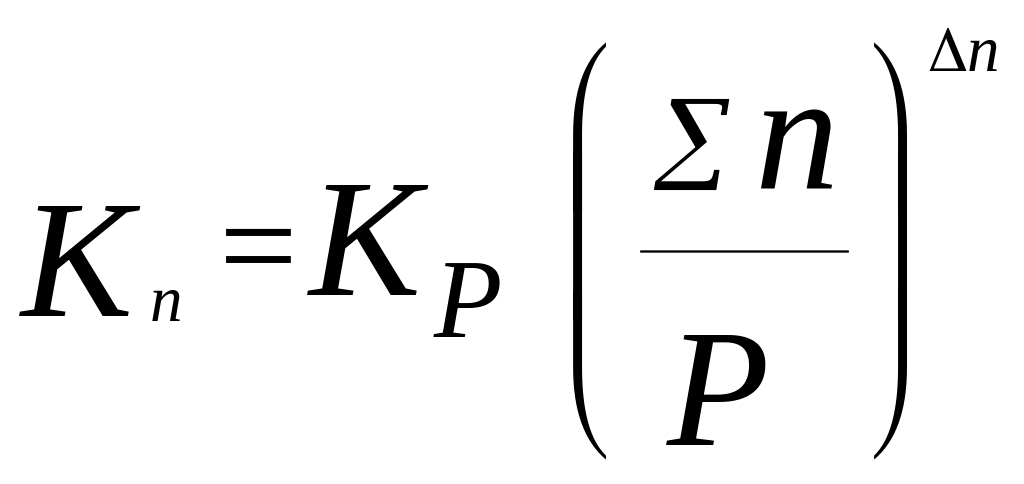 .
.
2.1.12. Рівняння ізотерми хімічної реакції Вант-Гофа
Для реакції aA + bB = dD + cC рівняння ізотерми Вант-Гофа має вигляд:
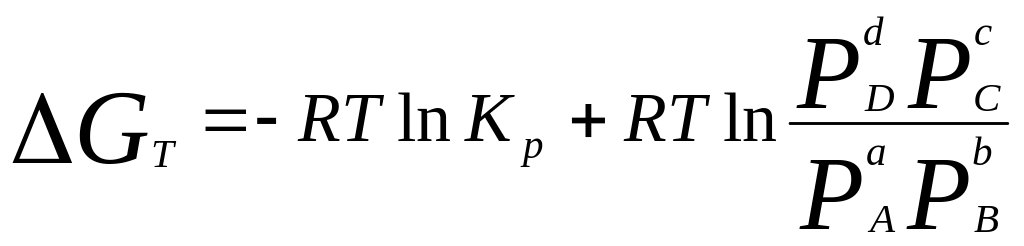
де
![]() ,
,![]() ,
,
![]() ,
,![]() - парціальні нерівноважні тиски реагентів
в момент початку реакції, а
- парціальні нерівноважні тиски реагентів
в момент початку реакції, а
![]() носить назву спорідненості реакції.
носить назву спорідненості реакції.
Якщо
![]() ,
то реакція перебігає в бік утворення
продуктів. Якщо ж
,
то реакція перебігає в бік утворення
продуктів. Якщо ж
![]() ,
то збільшується концентрація вихідних
речовин.
,
то збільшується концентрація вихідних
речовин.
Стандартна
хімічна спорідненість
(![]() )
:
)
:
![]() .
.
