
- •1. Отличительные особенности поведения полимеров
- •2. Строение полимеров
- •3. Классификация полимеров
- •1. Природные, искусственные и синтетические полимеры
- •2. Органические и неорганические полимеры
- •3. Термопласты и реактопласты
- •4. Пластики, эластомеры, волокна и смолы
- •4. Химия полимеризации
- •4.1. Цепная полимеризация
- •4.1.1. Свободнорадиакальная полимеризация
- •4.1.2. Ионная полимеризация
- •4.1.3. Координационная полимеризация
- •4.2. Ступенчатая полимеризация
- •4.2.1. Поликонденсация
- •4.2.2. Полиприсоединение
- •4.2.3. Полимеризация с раскрытием цикла
- •4.3. Особые типы полимеризационных реакций
- •4.3.1. Электрохимическая полимеризация
- •4.3.2. Полимеризация по механизму метатезиса
- •5. Способы проведения процессов полимеризации
- •6. Средняя молекулярная масса полимеров
- •6.1. Полидисперсность и кривые
- •7. Выделение и очистка полимеров
- •8. Фракционирование полимеров
- •9. Определение молекулярных масс полимеров
- •9.1. Криоскопия
- •9.2. Эбуллиоскопия
- •9.3. Мембранная осмометрия
- •9.4. Парофазная осмометрия
- •9.5. Вискозиметрия
- •9.6. Ультрацентрифугирование
- •9.7. Светорассеяние
- •10. Структура полимерных молекул
- •10.1. Микроструктуры, связанные с химическим строением полимеров
- •10.1.1. Гомоцепные и гетероцепные полимеры.
- •10.1.2. Гомополимеры и сополимеры.
- •10.2. Микроструктуры, связанные с геометрическим
- •10.3. Стереорегулярные полимеры
- •10.4. Геометрическая изомерия
- •11. Стеклообразное состояние полимеров
- •11.1 Агрегатные состояния веществ
- •11.2. Фазовые состояния веществ
- •11.3. Факторы, влияющие на температуру стеклования
- •11.4 Температура стеклования и молекулярная масса полимеров
- •11.5. Влияние пластификаторов на температуру стеклования
- •11.6. Значение температуры стеклования
- •12. Кристаллические полимеры
- •12.1. Полимерные монокристаллы
- •12.2. Влияние степени кристалличности на свойства полимеров
- •13. Химические превращения полимеров
- •14. Деструкция полимеров
- •14.1. Термическая деструкция
- •14.2. Механическая деструкция
- •14.3. Фотодеструкция
- •14.4. Радиационная деструкция
- •14.5. Окислительная деструкция
- •15. Переработка полимеров
4.1.3. Координационная полимеризация
К категории координационной полимеризации относят реакции олефинов и диенов в присутствии металлорганических катализаторов.
На первой стадии этого полимеризационного процесса образуется координационный комплекс между мономером и металлорганическим соединением

где Ме – переходный металл типа титана, молибдена, хрома, ванадия, никеля или родия.
При образовании этого мономер-катализаторного комплекса связь Ме-углерод мономера наиболее полярна и действует как активный центр, дающий начало росту полимерной цепи. Следующая молекула мономера встраивается по связи Ме–С. Однако, поскольку шестичленный цикл является термодинамически более стабильным, его структура сохраняется, а лишние атомы углерода вытесняются в сторону радикала R:

Аналогично происходит полимеризация винильных соединений. На первой стадии молекула мономера встраивается в металлорганическое соединение по связи металл–алкил.

Рост цепи происходит путем внедрения молекул мономера между металлом катализатора и углеродом цепи:

Важно отметить, что при таком типе присоединения молекулы мономера ориентируются относительно катализатора строго определенным образом, эта же ориентация сохраняется и в растущей цепи. Благодаря этому образуются стереорегулярные полимеры.
Часто при координационной полимеризации активный комплекс является гетерогенным, т.е. ион металла находится в твердой фазе, а ион карбония – в фазе растворителя. При внедрении молекулы мономера по связи Ме–С- полимерная цепь растет от поверхности катализатора в объем раствора:

По этой причине координационную полимеризацию называют еще полимеризацией внедрения.
При соответствующем подборе катализатора и растворителя молекулы мономера внедряются строго стереорегулярно.
Катализаторы Циглера-Натта
Катализаторы Циглера-Натта тоже широко используются в координационной полимеризации, но в отличие от просто элементоорганических соединений, эти катализаторы двухкомпонентны и даже в свободном виде представляют сложный координационный комплекс собственно катализатора и сокатализатора. Известны сотни таких каталитических систем, но наиболее часто применяют катализатор на основе триэтилалюминия или диэтилалюминийхлорида и сокатализатора – трихлорида или тетрахлорида титана.
В таких системах алкилалюминий является акцептором электронов, а хлорид титана – донором. Образуется нерастворимый в органических средах гетерогенный комплексный катализатор. Его строение может быть представлено следующими схемами:

Механизм действия такого катализатора весьма сложен. По «биметаллическому» механизму Натта активным центром в нем является связь Ti+–R-.
Молекула мономера образует с атомом титана -комплекс:
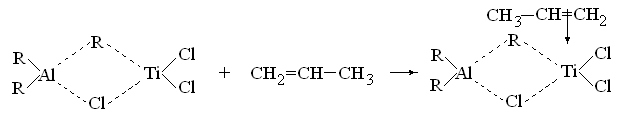
При этом электроны титана смещаются к радикалу, и связь Ti+–R- гетеролитически разрывается. Радикал становится карбанионом. Карбанион R- притягивает центральный атом мономера С+:


Образующийся 6-членный цикл с двумя атомами металла не является наиболее стабильным. Он стабилизируется, принимая исходную конфигурацию и начиная рост цепи.
Следующая молекула мономера повторяет весь путь и удлиняет цепь:

Нетрудно заметить, что группа СН3 каждый раз ориентирована в сторону от иона металла, поэтому полимерная цепь имеет стереорегулярное строение.
По механизму Натта в реакции координационной полимеризации всегда должны получаться изотактические полимеры, т.е. такие макромолекулы, в которых заместители расположены только по одну сторону цепи:

На самом деле, катализаторы Циглера-Натта позволяют получать и синдиотактические полимеры, в которых заместители попеременно располагаются по обе стороны цепи:

Такое строение цепи может быть объяснено «монометаллическим» механизмом, предложенным Косси.
По «монометаллическому» механизму Косси роль триэтилалюминия сводится лишь к алкилированию хлористого титана, сам алюминий никакого участия в дальнейшем не принимает.
Атом титана, как известно, имеет координационное число 6. В исходном состоянии пять координационных связей атома титана заняты атомами хлора, кроме того, есть одна вакантная d-орбиталь. Так можно выразить строение атома титана на поверхности твердого кристалла хлорида титана:

В то же время наиболее характерная валентность титана – 4. Поэтому 4 атома Сl связаны с другими ионами Тi в кристалле хлорида титана, а один, пятый, – оказывается подвижным, и он склонен к обмену с алкильной группой Аl(R)3.
При смешении ТiCl3 и Аl(R)3 происходит хемосорбция триалкилалюминия с образованием активного каталитического центра:

В результате образуется октаэдрический активный центр, где бывшая свободная d-орбиталь занята алкильным радикалом R, а на месте подвижного атома хлора появилась вакантная d-орбиталь. Молекулы мономера могут занимать эту d-орбиталь, связываясь с катализатором в -комплекс и -комплекс.

π-комплекс -комплекс
Этот переходный четырехчленный комплекс быстро перестраивается за счет внедрения мономера по связи Тi – R. При этом регенерируется вакантная d-орбиталь либо в положении R, либо в положении Сl.

Если вакантная d-орбиталь регенерируется всегда в одном положении, мономерное звено внедряется по связи Тi – R всегда в строго одном пространственном расположении, и образуется изоактический полимер.
Если расположение d-орбитали регулярно изменяется, то регулярно изменяется и пространственная ориентация заместителя Х в растущей полимерной цепи. Образуется синдиотактический полимер.
Способ регенерации d-орбитали зависит от заместителя Х в составе мономерной молекулы, структуры катализатора, температуры и некоторых других факторов.
