
- •Определим эквивалентную концентрацию ионов в воде и занесем получившийся результат в таблицу
- •Определим характеристики данной воды по классификации Пальмера:
- •Определим характеристики данной воды по классификации Пальмера:
- •Значение пластовых вод при эксплуатации нефтяных и газовых месторождений
- •Общие понятия о составе и свойствах пластовых вод
- •Жесткость воды.
- •Показатель концентрации водородных ионов.
- •Методы определения солевого состава пластовых вод
Министерство образования и науки Российской Федерации.
Федеральное агентство по образованию.
Государственное образовательное учреждение высшего образования.
Пермский Государственный Технический Университет.
Кафедра «Химические технологии топлива и углеродных материалов» (ТТУМ).
КОНТРОЛЬНАЯ РАБОТА.
По дисциплине «Химия нефти и газа»
Выполнил: Куреев М.А.
Группа – РНГМу-07-01з
Преподаватель: Федотов К.В.
Пермь 2010 г.
Вариант № 34 ФИО: Куреев М.А.
Задание I. Смесь нефтяных фракций имеющих следующие характеристики массу G кг; среднюю молекулярную массу М г/моль: плотность р кг/м3.
Бензина G = 1300, М= 106, р = 726;
керосина G = 3850, М= 166, р= 813;
легкого газойля G = 2650, М = 226, р= 861;
тяжелого газойля G = 3700, М = 286, р = 892;
мазута G = 2550, М = 346, р=913.
Найти: массовый, мольный и объемный состав смеси с точностью до 1 -ой десятой процента. Ответ представить в виде таблицы.
Ответ:Gсм=14050 кг
Компонент |
Массовая доля % |
Число килограм-молей кмоль |
Мольная доля % |
Объем м3 |
Объемная доля % |
Бензин |
9,3% |
12,264 |
18,2% |
1,791 |
10,8% |
Керосин |
27,4% |
23,193 |
34,4% |
4,736 |
28,6% |
Легкий газойль |
18,9% |
11,726 |
17,4% |
3,078 |
18,6% |
Тяжелый газойль |
26,3% |
12,937 |
19,2% |
4,148 |
25,1% |
Мазут |
18,1% |
7,370 |
10,9% |
2,793 |
16,9% |
Сумма |
100% |
67,490 |
100% |
16,545 |
100% |
Задание 2. Газовая смесь находится при следующих условиях давление Р - 5,2 атм, температура Т=145 °С. Компоненты газовой смеси при этих условиях имеют следующий объем м3: азот 80, углекислый газ 320, сероводород 195, метан 1150, этан 1400, пропан 3850, изо-бутан 3350 и н-бутан 2150. Найти: общую массу смеси, массовый и мольный состав смеси с точностью до 1-ой десятой процента. Ответ представить в виде таблицы.
Ответ: G смеси =86700 кг.
Компонент. |
Объем Vн м3 |
Нормальный объем Vн н. м3 |
Кол-во молей моль. |
Молярная масса газа кмоль |
Масса компонента. кг. |
Мольная доля % |
Массовая доля % |
Азот |
80 |
271,694 |
12,129 |
14,067 |
170,6 |
0,6% |
0,2% |
Углекислый газ |
320 |
1086,775 |
48,517 |
44,010 |
2135,2 |
2,6% |
2,5% |
Сероводород |
195 |
662,254 |
29,565 |
34,076 |
1007,5 |
1,6% |
1,2% |
Метан |
1150 |
3905,598 |
174,357 |
16,043 |
2797,1 |
9,2% |
3,2% |
Этан |
1400 |
4754,641 |
212,261 |
30,069 |
6382,5 |
11,2% |
7,4% |
Пропан |
3850 |
13075,263 |
583,717 |
44,096 |
25739,6 |
30,8% |
29,7% |
Изо-бутан |
3350 |
11377,177 |
507,910 |
58,123 |
29521,1 |
26,8% |
34,0% |
Н-бутан |
2150 |
7301,770 |
325,972 |
58,123 |
18946,4 |
17,2% |
21,9% |
Сумма |
12495 |
42435,172 |
1894,427 |
45,766 |
86700,0 |
100,0% |
100,0% |
Задание 3. Найти среднюю молекулярную массу нефтяных фракций по их физическим характеристикам; начало кипения н.к. °С, конец кипения к.к. °С, характеристический фактор К, абсолютная плотность при 20°С р кг/м3 Фракция А н.к. = 130, к.к. = 170, К = 10,8; фракция В н.к. = 490, к.к. = 440. К = 12,2; фракция С = 755; фракция D = 905. Определить среднюю молекулярную массу смеси этих фракций, если они смешиваются:
в мольном соотношении A/B/C/D как 4/9/7/1;
в массовом соотношении A/B/C/D как 8/2/3/6;
в объемном соотношении A/B/C/D как 5/3/4/8.
Решение:
Найдем среднюю молекулярную массу фракции А по формуле Войнова:
М=(7*К-21,5)+(0,76-0,04*К)*t+(0,003K-0,00245)*t2=(7*10,8-21,5)+(0,76-0,04*10,8)*150+(0,0003*10,8-0,00245)*1502=121,075
Найдем среднюю молекулярную массу фракции B по формуле Войнова:
М=(7*К-21,5)+(0,76-0,04*К)*t+(0,003K-0,00245)*t2=(7*12,2-21,5)+(0,76-0,04*12,2)*465+(0,0003*12,2-0,00245)*4652=452,012
Найдем относительные плотности фракций С и D
1515=204+5*0,000831=0,755+0,004155=0,7592
1515=204+5*0,000633=0,905+0,003165=0,9082
Найдем среднюю молекулярную массу фракции С по формуле Крэга:
М=(44,29*1515)/(1,03-1515)= (44,29*0,7592)/(1,03-0,7592)=124,141
Найдем среднюю молекулярную массу фракции D по формуле Крэга:
М=(44,29*1515)/(1,03-1515)= (44,29*0,9082)/(1,03-0,9082)=330,140
Найдем среднюю молекулярную массу 1 смеси:
М=(4/21)*121,075+(9/21)*452,012+(7/21)*124,141+(1/21)*330,140=273,883
Найдем среднюю молекулярную массу 2 смеси:
М=1/(8/19/121,075+2/19/452,012+3/19/124,141+6/19/330,140)=168,381
Найдем среднюю молекулярную массу 3 смеси, (предварительно найдя по формуле Крэгга плотности фракций А и В):
М=1/((5/20)*0,750*121,075+(3/20)*0,935*452,012+(4/20)*0,755*124,141+(8/20)*0,905*330,140)=
=239,707
Ответ:
Фракция. |
Начало кипения (н.к.) С |
Конец кипения (к.к) °С |
Характеристический фактор К |
Абсолютная плотность при 20°С р420 кг/м3 |
Средняя температура кипения. |
Средняя молекулярная масса. г/моль |
Относительная плотность при 15°С р1515 |
А |
130 |
170 |
10,8 |
750 |
150 |
121,075 |
0,754 |
В |
440 |
490 |
12,2 |
935 |
465 |
452,012 |
0,938 |
С |
|
|
|
755 |
|
124,141 |
0,759 |
D |
|
|
|
905 |
|
330,140 |
0,908 |
Смесь |
|
|
|
|
|
|
|
мольная 4/9/7/1 |
|
|
|
|
|
273,883 |
|
массовая 8/2/3/6 |
|
|
|
|
|
168,381 |
|
объемная 5/3/4/8 |
|
|
|
|
|
239,707 |
|
Задание 4. По физическим характеристикам нефтяных фракций: фракция А °АР1 = 61,5; фракция В °АР1 = 22; фракция С р = 745 кг/м3; фракция D р = 900 кг/м3. Найти среднюю молекулярную массу смеси этих фракций, плотность смеси при температуре 20°С и плотность смеси при температуре t = 76°С, если они смешиваются:
в объемном соотношении A/B/C/D как 4/2/5/7;
в массовом соотношении A/B/C/D как 5/3/4/2;
в мольном соотношении A/B/C/D как 4/2/7/5.
Решение:
Найдем плотности фракций при 15С
Для A 1515=141,5/(API+131,5)= 141,5/(61,5+131,5)=0,733
Для В 1515=141,5/(API+131,5)= 141,5/(22+131,5)=0,922
Для С 1515=204+5*=0,745+5*0,000844=0,749
Для D 1515=204+5*=0,900+5*0,000633=0,903
Найдем средние молекулярные массы фракций по формуле Крэга:
Для A М=(44,29*0,733)/(1,03-0,733)=109,391
Для В М=(44,29*0,922)/(1,03-0,922)=377,419
Для С М=(44,29*0,749)/(1,03-0,749)=118,181
Для D М=(44,29*0,903)/(1,03-0,903)=315,380
Найдем абсолютную плотность для фракций при Т=76°С Для A 76=20-(76-20)=0,728-0,00087*(76-20)=0,680
Для В 76=20-(76-20)=0,918-0,00062*(76-20)=0,870
Для С 76=20-(76-20)=0,745-0,000844*(76-20)=0,696
Для D 76=20-(76-20)=0,900-0,00087*(76-20)=0,851
Найдем среднюю молекулярную массу 1 смеси:
М=1/((4/18)*0,729*109,391+(2/18)*0,919*377,419+(5/18)*0,745*118,181+(7/18)*0,900*315,380)=
=216,825
Найдем среднюю молекулярную массу 2 смеси:
М=1/((5/14)*109,391+(3/14)*377,419+(4/14)*118,181+(2/14)*315,380)=
=149,184
Найдем среднюю молекулярную массу 3 смеси:
М=(4/18)*109,391+(2/18)*377,419+(7/18)*118,181+(5/18)*315,380=199,809
Ответ:
Фракция. |
PI |
Абсолютная плотность при 20°С кг/м3 |
Относительная плотность при 15°С кг/м3 |
Средняя молекулярная масса. г/моль |
Абсолютная плотность при Т=76°С кг/м3 |
А |
61,5 |
728,876 |
0,733 |
109,391 |
680,156 |
В |
22 |
918,789 |
0,922 |
377,419 |
870,069 |
С |
|
745,000 |
0,749 |
118,181 |
696,280 |
D |
|
900,000 |
0,903 |
315,380 |
851,280 |
Смесь |
|
|
|
|
|
4/2/5/7 объемная |
|
821,004 |
|
216,825 |
779,676 |
5/3/4/2 массовая |
|
790,228 |
|
149,184 |
748,900 |
4/2/7/5 мольная |
|
839,554 |
|
199,809 |
798,226 |
Задание 5. Найти абсолютную и относительную плотность газа при нормальных условиях (t = 0°С, Р = 1 атм), а также плотность этого газа при температуре t = 130°С и давлении Р = 0,78 МПа. Состав газа мас.% следующий: азот 2, углекислый газ 3, сероводород 1, метан 37, этан 18. пропан 15, изо-бутан 7, н-бутан 8, н-пентан 9.
Решение:
Найдем молекулярные массы газов смеси.
Найдем среднюю молекулярную массу смеси
М=(2+3+1+37+18+15+7+8+9)/(2/28+3/44+1/34+37/16+18/30+15/44+7/58+8/58+9/112)=26,586
Найдем относительную плотность газа
отн=26,586/28,9=0,920
Найдем абсолютную плотность газа
абс=26,586/22,4=1,187 кг/м3
Найдем плотность газа при заданных условиях
=(26,586/22,4)*(273*0,78/273+130)=6,271 кг/м3
Состав газа |
% |
Молекулярная масса газа. г/моль |
Относительная плотность при н.у. (0°С, Р=1 атм) |
Абсолютная плотность при н.у (0°С, Р=1 атм) кг/м3 |
Абсолютная плотность при 130°С, Р-0,78 МПа кг/м3 |
Азот |
2 |
28 |
|
|
|
Углекислый газ |
3 |
44 |
|
|
|
Сероводород |
1 |
34 |
|
|
|
Метан |
37 |
16 |
|
|
|
Этан |
18 |
30 |
|
|
|
Пропан |
15 |
44 |
|
|
|
Изо-бутан |
7 |
58 |
|
|
|
Н-бутан |
8 |
58 |
|
|
|
Н-пентан |
9 |
112 |
|
|
|
Сумма |
100 |
26,586 |
0,920 |
1,187 |
6,271 |
Ответ:
Молекулярная масса газа 26,586 г/моль.
абс=1,187 кг/м3;
отн=0,920; г=6,271 кг/м3
Задание 6. Узкая нефтяная фракция при атмосферном давлении имеет среднюю температуру кипения 143°С. Какую среднюю температуру кипения будет иметь эта фракция при давлении Р = 5,0 атм.? Расчет провести по методу Ашворта. Найти молекулярную массу и абсолютную плотность фракции.
Решение:
Найдем f(T0)=1250/((143+273)2+108000)-307,6)1/2=4,617,
тогда f(T)=4,617*(1-0,7/2,68)=3,413.
Отсюда найдем Т=218С.
По формуле Войнова найдем среднюю молекулярную массу смеси:
М=60+0,3*143+0,001*1432=123 г/моль,
по формуле Крэгга найдем относительную плотность смеси
1515=0,758,
найдем абсолютную плотность при 20С
420=(0,758+5*0,00831)=762кг/м3
Ответ:
tкип5=218С;
М=123 г/моль;
=762 кг/м3
Задание 7. Узкая нефтяная фракция при давлении Р = 9,0 атм. имеет среднюю температуру кипения 368°С. Какую среднюю температуру кипения будет иметь эта фракция при атмосферном давлении ? Расчет провести по методу Ашворта. Найти молекулярную массу и абсолютную плотность фракции.
Найдем f(T)=2,029, тогда f(T0)=3,150. Отсюда найдем t=239С.
По формуле Войнова найдем М=189,2 г/моль, по формуле Крэгга 1515=0,835, учитывая что абсолютная плотность при н.у. совпадает с относительной найдем 420=838 кг/м3
Ответ:tкип1=239С; М=189,2 г/моль; =838 кг/м3
Задание 8. Узкая нефтяная фракция при атмосферном давлении имеет среднюю температуру кипения 168°С. Какую среднюю температуру кипения будет иметь эта фракция при давлении Р = 0,92 МПа? Расчет провести по методу Максвелла. Найти молекулярную массу и абсолютную плотность фракции.
Найдем f(t0)=14,095, тогда f(t)=18,631. Отсюда найдем t=277С.
По формуле Войнова найдем М=60+0,3*168+0,001*1682=138,6 г/моль,
по формуле Крэгга 1515=0,781,
учитывая что абсолютная плотность при н.у. совпадает с относительной найдем
420=(0,781+5*0,000792)=785 кг/м3
Ответ:
tкип9,2=277С;
М=138,6 г/моль;
=785 кг/м3
Задание 9. Узкая нефтяная фракция при давлении Р = 0,62 МПа имеет среднюю температуру кипения 396°С. Какую среднюю температуру кипения будет иметь эта фракция при атмосферном давлении ? Расчет провести по методу Максвелла. Найти молекулярную массу и абсолютную плотность фракции.
Найдем f(t)
f(t)= (37*396)/(396+273)=21,901,
тогда f(t0) для Р=6,2 f(t0)=19,303.
Найдем t0=298С.
По формуле Войнова найдем среднюю молекулярную массу смеси
М=60+0,3*298+0,001*2982=238 г/моль,
по формуле Крэгга 1515=(44,29*238)/(1,03-238)=0,868
учитывая что абсолютная плотность при н.у. совпадает с относительной найдем
420=(0,868+5*0,000686)=872 кг/м3
Ответ:
tкип1=298С;
М=238 г/моль;
=872 кг/м3
Задание 10. Узкая нефтяная фракция при атмосферном давлении имеет среднюю температуру кипения 115°С. Какую среднюю температуру кипения будет иметь эта фракция при давлении 8000 мм рт. ст.? Для решения использовать график Кокса. Также по номограмме решите задачи № 6, 7, 8, 9 сравните получившиеся результаты. (Письменно!).

Ответ: tкип10,5218С
Для задачи 6 по графику Кокса tкип5217С, (погрешность 0,4%).
Для задачи 7 по графику Кокса tкип1240С, (погрешность 0,4%)
Для задачи 8 по графику Кокса tкип9,2275С, (погрешность 0,7%)
Для задачи 9 по графику Кокса tкип1288С, (погрешность 1%)
Задание 11. Узкая нефтяная фракция при остаточном давлении 0,5 мм рт. ст. имеет среднюю температуру кипения 170°С. Какова средняя температура кипения данной фракции при атмосферном давлении? Для решения использовать номограмму UOP.
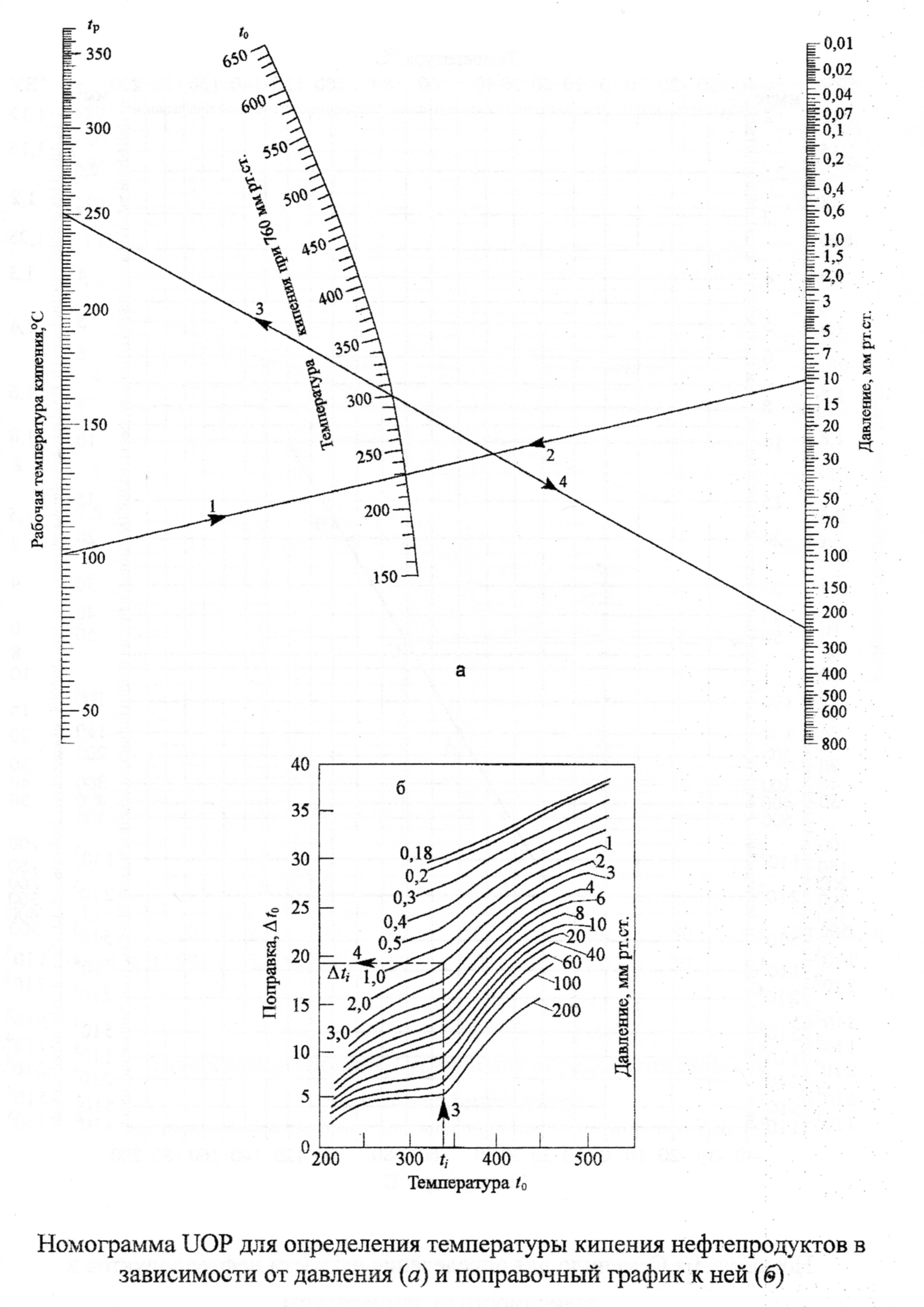
Температура по номограмме UOP 382С, поправка 27С, средняя температура кипения данной фракции при атмосферном давлении 382-27=355С.
Ответ: tкип=355С.
Задание 12. Фракция А при температуре 10°С имеет вязкость 400 мм2/с, а при температуре 90°С ее вязкость 60 мм2/с. Фракция В при температуре 10°С имеет вязкость 180 мм2/с, а при температуре 90°С ее вязкость 12,5 мм2/с. Найти вязкости этих фракций при температурах 0°С, 40°С и 110°С. Для решения использовать номограмму Семенидо.

Ответ: для фракции А вязкость при 0С =550мм2/с, при 40°С =170 мм2/с, при 110°С =44 мм2/с.
для фракции В вязкость при 0С =300мм2/с, при 40°С =50 мм2/с, при 110°С =8 мм2/с.
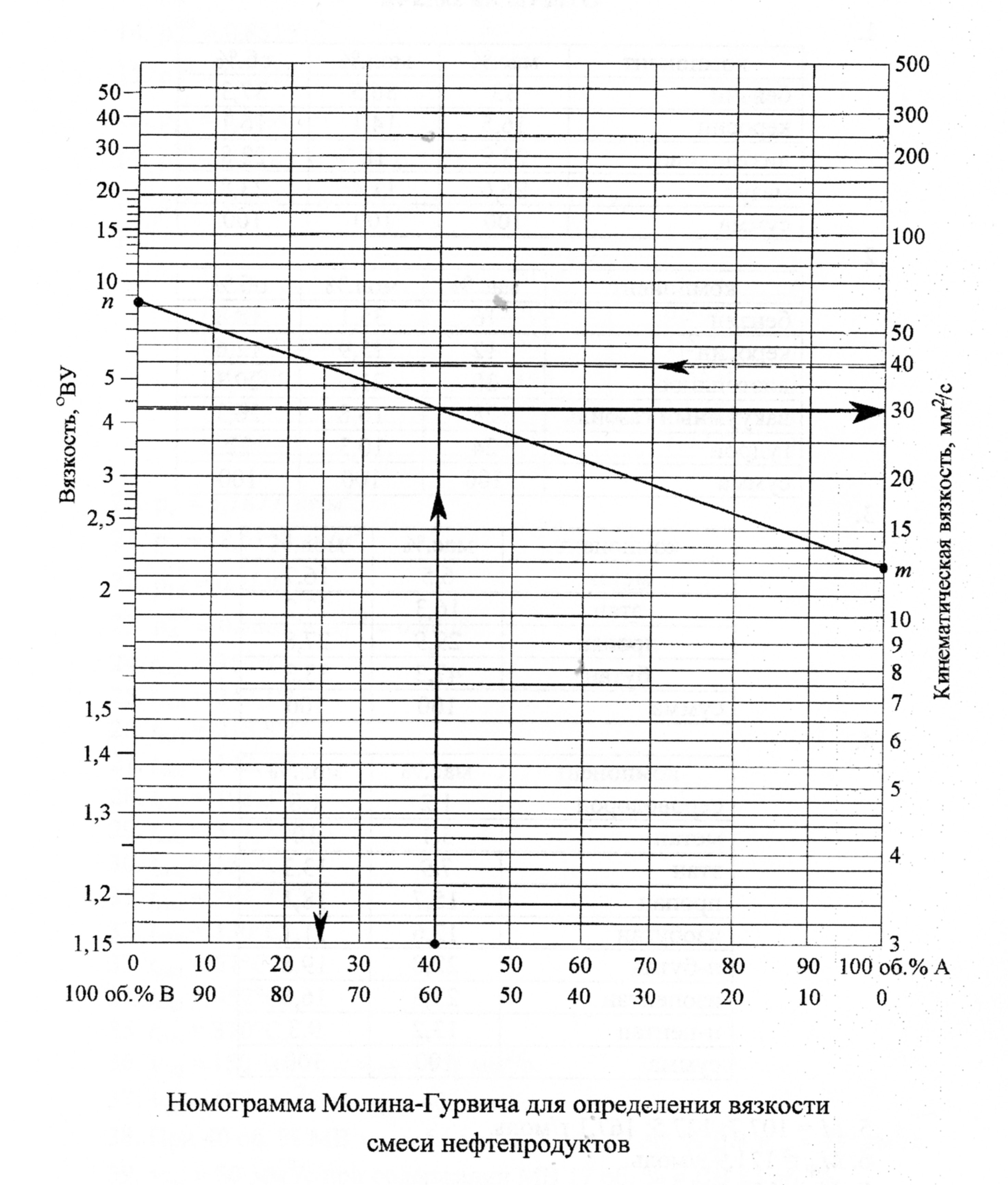
Задание 13. Для нефтяных фракций А и В из задания 12 определить номограммы Молина- Гурвича:
вязкость смеси этих фракций при температуре 20°С, если они смешиваются в количестве 20 об.% фракций А и 80 об.% фракций В; при той же температуре найти состав смеси этих фракций при котором вязкость смеси будет равна 181 мм2 /с;
вязкость смеси этих фракций при температуре 50°С, если они смешиваются в количестве 40 об% фракций А и 60 об.% фракций В; при той же температуре найти состав смеси этих фракций при котором вязкость смеси будет равна 98 мм2/с;
вязкость смеси этих фракций при температуре 100°С, если они смешиваются в количестве 70 об. % фракций А и 30 об% фракций В; при той же температуре найти состав смеси этих фракций при котором вязкость смеси будет равна 16 мм2/с.
Найдем вязкости фракций по номограмме Семенидо:
При 20°С вязкость фракции А=290 мм2/с, фракции В =110 мм2/с
При 50°С вязкость фракции А=130 мм2/с, фракции В =34 мм2/с
При 100°С вязкость фракции А=50 мм2/с, фракции В =10 мм2/с
Ответ: - при 20С вязкость смеси =130 мм2/с; вязкости 181 мм2 /с соответствует состав смеси фракции А =43%, фракции В =57%
- при 50С вязкость смеси =58 мм2/с; вязкости 98 мм2/с соответствует состав смеси фракции А =83%, фракции В =17%
- при 100С вязкость смеси =29 мм2/с; вязкости 16 мм2/с , соответствует состав смеси фракции А =30%, фракции В =70%
Задание 14. Классифицируйте пластовую воду по классификациям Пальмера и Сулина изобразите ее солевой состав на колонке Роджерса. Если содержание ионов воде в мг/л составляет: хлор иона 2500; сульфат иона 4500; гидрокарбонат иона 19000; иона кальция 1200; иона магния 2500; иона калия 500 и иона натрия 4474.
Так как классификация по Сулину выполняется на основе классификации по Пальмеру, то сначала классифицируем данную воду по классификации Пальмера:
Определим эквивалентную концентрацию ионов в воде и занесем получившийся результат в таблицу
Ионы.
Концентрация ионов.
мг/л.
мг-экв.
%-экв
Cl-
2500
70,52
7,41
SO42-
4500
93,75
9,85
HCO3-
19000
311,48
32,74
Ca2+
1200
60,00
6,31
Mg2+
2500
208,33
21,90
Na+
4474
194,52
20,45
K+
500
12,82
1,35
сумма
880,54
100
Определим характеристики данной воды по классификации Пальмера:
По результатам расчета
a=rNa+rK=194,52+12,82=207,34
b=r Mg2++r Ca2+=208,33+60,00=268,33
d=r Cl-+r SO42-=70,52+93,75=164,27
Так как d<а – вода I класса,
В данной воде сумма процент-эквивалентов ионов щелочных металлов больше чем сумма процент-эквивалентов сильных кислот сильных кислот, следовательно первичную соленость составят все процент-эквиваленты сильных кислот с равным им количеством процент-эквивалентов щелочных металлов.
Первичная соленость этой воды равна:
S1= (Cl-+SO42-)*2=(7,41+9,85)*2=17,27*2=34,53
Первичная щелочность, составят процент-эквивиаленты ионов щелочных металлов, оставшиеся после образования S1, с равным им количеством процент-эквивалентов ионов слабых кислот.
A1 =(Na++K+)-S1/2=(20,45+1,35)-34,52/2=9,04
Вторичная соленость отсутствует, т.к. ионы сильных кислот израсходованы на первичную соленость т.е. S2=0
Вторичную щелочность данной воды составят процент-эквиваленты ионов слабых кислот, оставшиеся в избытке после их соединения с процент-эквивалентами ионов щелочных металлов, с равным им количеством процент-эквивалентов ионов щелочноземельных металлов.
А2=(( НCО3--(А1/2))*2=(32,74-9,04/2)*2=(32,74-4,53)*2=28,21*2=56,42
Классифицируем данную воду по классификации Сулина:
а) подсчитаем коэффициент r(Na++K+)/rCl-. Для рассматриваемой воды он равен
r(Na++K+)/rCl-=(194,52+12,82)/70,52=2,94
т.е больше единицы. Значит рассматриваемая вода относится к типу гидрокарбонатно-натриевых или к типу сульфатно-натриевых.
б) определим величину соотношения r(Na++K+)-rCl-/rSO42-
r(Na++K+)-rCl-/rSO42-=(194,52+12,82-70,52)/93,75=1,46
т.е больше единицы, значит рассматриваемая вода относится к типу гидрокарбонатно-натриевых.
Определим величину соотношения rHCO3-/rCl- и rHCO3-/rSO42-
rHCO3-/rCl-=311,48/70,52=4,42
rHCO3-/rSO42-=311,48/93,75=3,32
т.к. оба отношения больше единицы – вода относится к группе гидрокарбонатных вод.
Определим величины соотношений r(Na++K+)/rCа2+ и r(Na++K+)/rMg+
r(Na++K+)/rCа2+=(20,45+1,35)/6,31=3,46
r(Na++K+)/rMg+=(20,45+1,35)/21,90=0,995
т.к. отношение к rMg+ меньше единицы, вода относится к подгруппе магниевых вод.
Запишем формулу воды по Пальмеру А2S1A1, доминирующей характеристикой Пальмера является первичная щелочность А2 а следовательно вода относится к классу А2.
Получившиеся результаты нанесем на колонку Роджерса:
Ответ:
50 |
|
|
|
|
|
100 |
|
|
|
|
|
|
|
|
90 |
|
|
40 |
|
|
|
|
|
80 |
|
|
|
Mg2+ |
|
HCO3- |
A2 |
|
70 |
|
|
30 |
|
|
|
|
|
60 |
|
|
|
|
|
|
|
|
50 |
|
|
20 |
Na+ K+ |
|
|
|
|
40 |
|
|
|
|
|
SO42- |
S1 |
|
30 |
|
|
10 |
|
|
|
|
|
20 |
|
|
|
Ca2+ |
|
Cl- |
|
|
10 |
|
|
|
|
|
|
А1 |
|
0 |
|
|
Характеристика пластовой воды по Пальмеру Вода I класса А2=56,42 S1=34,53 А1=9,04 |
Характеристика пластовой воды по Сулину Тип – I сульфатно-натриевый Группа – гидрокарбонатных вод Класс - А2 Подгруппа - магниевых |
|||||||
Задание 15. Классифицируйте пластовую воду по классификациям Пальмера и Сулина изобразите ее солевой состав на колонке Роджерса. Если содержание ионов воде в мг/л составляет: хлор иона 9000; сульфат иона 5500; гидрокарбонат иона 12500; иона кальция 3800; иона магния 2200; иона калия 700 и иона натрия 4180.
Ионы. |
Концентрация ионов. |
|||
мг/л. |
а.е.м |
мг-экв. |
%-экв |
|
Cl- |
9000 |
35,45 |
253,88 |
22,15 |
SO42- |
5500 |
48,00 |
114,58 |
10,00 |
HCO3- |
12500 |
61,00 |
204,92 |
17,87 |
Ca2+ |
3800 |
20,00 |
190,00 |
16,57 |
Mg2+ |
2200 |
12,00 |
183,33 |
15,99 |
Na+ |
4180 |
23,00 |
107,18 |
15,85 |
K+ |
700 |
39,00 |
30,43 |
1,57 |
Сумма |
|
|
1084,33 |
100,00 |
