
- •Научные основы современных сталеплавильных процессов
- •Посвящается в.И. Явойскому
- •Глава 1
- •Глава 2
- •2.1 Кинетика гетерогенных высокотемпературных процессов и методы выявления их ведущего звена
- •2.2 Исследование процессов окислительного рафинирования имеющих место в производстве стали
- •2.3 Условия протекания окислительного рафинирования в сталеплавильных агрегатах
- •2.4 Реакция окисления углерода
- •Внутридиффузионный режим лимитирования процесса
- •2.7 Окислительные процессы в многокомпонентных расплавах на основе железа
- •2.10 Окисление серы
- •2.11 Деванадация
- •2.13 Современные представления о ходе процессов окислительного рафинирования расплавов на основе железа
- •Окислительное рафинирование в условиях современных сталеплавильных агрегатов
- •2.15 Характеристика и газодинамика кислородных струй сталеплавильных агрегатов
- •Форма и геометрические размеры реакционной зоны
- •Глава 3.
- •3.1 Общие положения
- •3.2 Маcсоперенос примеси в экстрагирующей фазе
- •3.3 Сера в металле и его десульфурация
- •3.4 Кинетика процесса десульфурации металла
- •3.5 Кинетика десульфурации металла за счет твердых тел (порошкообразными десульфураторами)
- •Глава 4. Раскисление стали и неметаллические включения.
- •4.1 Кислород в стали и ее раскисление
- •4.2 Термодинамика раскисления
- •4.3 Кинетика осадочного раскисления
- •4.4 Плавление и растворение в металле вводимых раскислителей
- •4.5 Взаимодействие растворенного в металле кислорода с введенным в него раскислителем
- •4.6 Образование зародышей новой фазы продуктов раскисления в объеме жидкого металла
- •4.7 Рост образовавшихся продуктов раскисления
- •4.8 Удаление продуктов раскисления из сферы протекания этой реакции
- •4.9 Переход включений из металла в шлак или другие контактирующие фазы
- •4.10 Неметаллические включения в готовом металле
- •Глава 5 газы в стали
- •5.1 Взаимодействие азота и водорода с расплавленным и охлаждающимися сплавами железа
- •5.2 Термодинамика взаимодействия азота с расплавами на основе железа
- •5.3 Методы изучения взаимодействия азота с металлами
- •5.4 Кинетика растворения азота в железе и его сплавах
- •Глава 6 поведение водорода в сплавах на основе железа
- •6.1 Некоторые особенности взаимодействия водорода
- •Со сплавами на основе железа
- •6.2 Природа газообразного водорода и взаимодействие его с металлами
- •6.3 Термодинамика сорбирования водорода расплавленными и твердыми сплавами железа
- •6.4 Кинетика растворения и выделения водорода из расплавов на основе железа
- •6.5 Состояние водорода в готовой стали его влияние на механические свойства стали и распределение водорода в металле
- •6.6 Поведение водорода при выплавке металла и при его внепечной обработке
- •Глава 7 основы обработки стали в ковше
- •7.1 "Внеагрегатная" или "ковшевая" обработка стали
- •7.2 Вакуумирование металла
- •7.3 Применение инертных газов
- •Заключение
- •Библиографический список
- •Оглавление
- •Научные основы современных сталеплавильных процессов
2.7 Окислительные процессы в многокомпонентных расплавах на основе железа
Окисление многокомпонентных расплавов на основе железа имеет место в большинстве промышленных способов производства стали, поэтому оно представляет особый практический интерес. Весьма значителен и чисто научный интерес таких вопросов, как участие в шлакообразовании отдельных компонентов расплава и их взаимная роль как составных компонентов формирующихся шлаков, соотношение скоростей окисления отдельных компонентов металлического расплава, распределение между ними кислорода, вступающего в контакт с металлом, последовательность окисления отдельных элементов многокомпонентного сплава и ряд других вопросов, имеющих различные ответы в зависимости от разных частных обстоятельств.
2.8 Соотношение скоростей окисления отдельных
компонентов расплавов на основе железа
Вопрос об относительных скоростях окисления отдельных компонентов чугунов, перерабатываемых в бессемеровских и томасовских конвертерах был впервые рассмотрен и, для того времени, весьма удачно решен М.М. Карнауховым [51] в 1923 году. М.М. Карнаухов считал, что "относительные скорости" окисления отдельных компонентов чугунов, а значит, и последовательность их окисления и их защитная роль по отношению друг к другу определяются чисто термодинамическим параметром – упругостью диссоциации оксида, образуемого тем или иным элементом. Он не настаивал на точных математических связях, считал, что имеются отчетливые качественные связи:
VC:VMn:VSi:VP= ,
(62)
,
(62)
где значения упругости диссоциации оксидов относятся к реакциям растворенного в металле компонента с образованием его в растворе в шлаковой, или в газовой фазах. Например, для кремния:
![]() (63)
(63)
Саму величину упругости диссоциации оксида М.М. Карнаухов рассчитывал через константу равновесия процесса образования оксида (например, [Si]+O2газ=(SiO2) используя экспериментальные данные о (SiO2) и [Si] и применяя упрощенную формулу Нернста [51]:
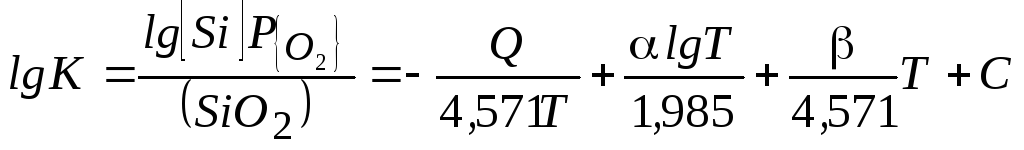 , (64)
, (64)
где Q – энтальпия рассматриваемой реакции,
Т – температура (К),
и – постоянные коэффициенты в эмпирических выражениях для определения теплоемкости реагирующих веществ;
C – постоянная интегрирования (для кислорода С=2,8).
Хотя вынужденные допущения М.М. Карнаухова, конечно, не имеют строгой научной основы, чисто качественно они хорошо описывали процессы окислительного рафинирования и широко применялись металлургами на протяжении ряда лет.
2.9 Роль поверхностной активности компонентов
расплавов на основе железа
В современных условиях в связи со все возрастающими потребностями интенсификации процессов рафинирования металла, главным образом за счет резкого увеличения удельной поверхности контакта его с извлекающими примеси фазами (газом, шлаком и т.д.), очень обострилась необходимость подробного рассмотрения и детального изучения самого акта перехода атомов растворенных в металле элементов в поверхностный слой металла на его границе с контактирующими с ним фазами. В связи с этим возрос и интерес к вопросу о влиянии поверхностной активности компонентов металлических расплавов на скорости процессов их рафинирования и о возможностях управления относительными скоростями, а, значит, о последовательности удаления из металла отдельных компонентов расплава.
Значительные успехи науки в области изучения поверхностных явлений вообще и, в частности, в металлургии, позволяют сейчас дать некоторые уточнения и в кинетику окислительного рафинирования многокомпонентных сплавов железа. Впервые этот вопрос был рассмотрен В.И. Явойским и А.Ф. Вишкаревым [52] Позднее С.И. Попель и В.В. Павлов [53, 54] дали подробную количественную оценку влиянию адсорбции отдельных компонентов сплавов железа на кинетику их рафинирования.
Компоненты расплава, заключающиеся в каждом элементарном его объеме, стремятся к равновесному распределению в объеме и в поверхностном слое. "Поверхностное сгущение" компонента (или его адсорбция – Г) определяется уравнением:
Г=([A]об/RT)(d/d[A]об). (65)
Мгновенное значение концентрации рассматриваемого компонента в поверхностном слое определится уравнением:
[А]мгн.пов.=[А]об+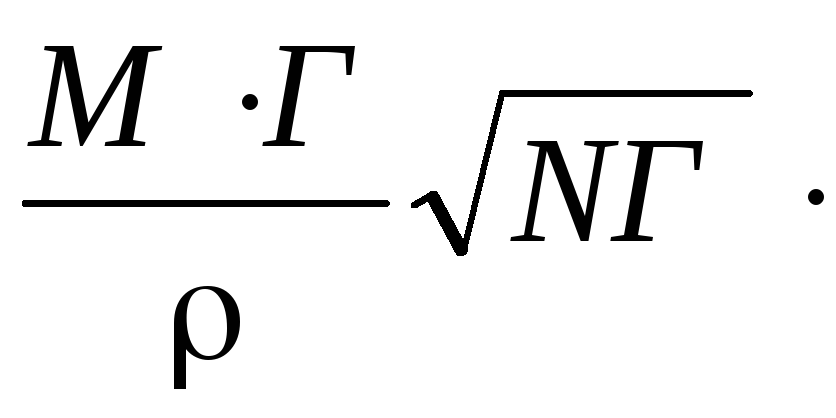 100
%, (66)
100
%, (66)
где [А]об – концентрация данного элемента в объеме раствора;
[А]мгн.пов – его поверхностная концентрация;
N – число Авогадро;
– плотность расплава;
M – атомный вес адсорбируемого компонента;
– поверхностное натяжение расплава.
В условиях контакта металла с окислительной газовой фазой значение мгновенной поверхностной концентрации любого компонента расплава в общем случае является функцией ряда переменных:
[А]мгн.пов=f([A]обDAWAГA), (67)
где DA – коэффициент диффузии (в частности, молекулярной) компонента А в расплавленном металле, определяющий снабжение поверхностного слоя компонентом А,
WА – скорость окисления элемента А на поверхности расплавленного металла, определяемая окислительным потенциалом газовой фазы и скоростью массопереноса в ней окислителя к поверхности металла.
[А]мгн.пов→0 при высоком окислительном потенциале газа или при низких значениях [А]об. В связи с относительно малым значением массы металла, составляющей его поверхностный слой, склонность отдельных элементов к адсорбции может иметь практическое значение только при очень большом значении величины удельной поверхности контакта металл-газ, т.е. при мелкодиспергированной металлической фазе.
Исходя из этих соображений С.И. Попель и др. [54] вывели следующее соотношение для скоростей окисления шлакообразующих элементов металлической ванны:
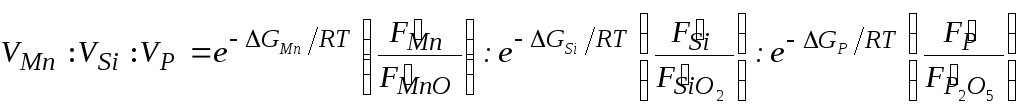 (68)
(68)
где ΔGMn, ΔGSi и ΔGP – изобарно-изотермические потенциалы окисления марганца, кремния и фосфора;
![]() – константы,
характеризующие поверхностную активность
марганца, кремния и фосфора;
– константы,
характеризующие поверхностную активность
марганца, кремния и фосфора;
![]() – константы,
характеризующие поверхностную активность
оксидов MnO,
SiO2
и P2O5
в образующихся шлаковых расплавах.
– константы,
характеризующие поверхностную активность
оксидов MnO,
SiO2
и P2O5
в образующихся шлаковых расплавах.
Из приведенного уравнения следует, что относительные скорости окисления примесей металла определяются их сродством к кислороду (G) и поверхностными активностями. При заданных составах металла и шлака тот или иной компонент окисляется тем быстрее, чем больше его сродство к кислороду (т.е. чем более отрицательно значение G), чем больше его капиллярная активность в металле и чем меньше капиллярная активность оксида этого элемента в шлаке.
Эти уточнения кинетики процессов окислительного рафинирования пока не получили широкого распространения, т.к. обычно кинетические кривые, достроенные для той или иной плавки с учетом способностей отдельных элементов к адсорбции мало отличаются от рассчитанных по М.М. Карнаухову с учетом только величины сродства элемента к кислороду при данных условиях. С чисто научных позиций использование сведений о поверхностной активности элементов (констант F΄Mn, F΄Si и т.д.), а также о поверхностной активности оксидов этих элементов в шлаках (констант F΄MnO и т.д.) нельзя считать строгим, т.к. все они являются константами, характеризующими равновесное распределение элемента или его оксида между объемом и поверхностным слоем металла или шлака и, следовательно, не описывают кинетику процесса перехода атомов элемента из объема металла в поверхностный слой или оксида в поверхностный слой шлака. Тем не менее можно привести также ряд примеров отчетливо выраженного влияния поверхностной активности отдельных элементов на практику окислительного рафинирования в современных условиях, некоторые из них приведены ниже.
