
- •7. Правила заполнения электронами атомных орбиталей (принцип минимальной энергии, правило Клечковского, правила Паули и Гунда.)
- •Гидролиз солей: типы, константа и степень гидролиза.
- •Сильные (активность, коэффициент активности, ионная сила) электролиты.
- •Химические источники тока: гальванические элементы (эдс)
- •Пример - батарейка
- •Коррозия металлов: химическая
- •34. Понятие о комплексных соединениях: строение, номенклатура.
- •1.Основные законы и понятия в химии.
- •Константа воды. Водородный показатель (pH).
- •28. Окислительно-восстановительные реакции: степень окисления, окислитель и восстановитель (важнейшие окислители и восстановители), типы окислительно-восстановительных реакций.
- •Идеальные растворы. Растворы неэлектролитов: понятия диффузии и осмоса. Разбавленные и концентрированные растворы; насыщенный раствор.
- •2.Оксиды, типы оксидов. Методы получения, химические свойства, номенклатура основных, кислотных, амфотерных.
- •Буферные растворы.
-
Идеальные растворы. Растворы неэлектролитов: понятия диффузии и осмоса. Разбавленные и концентрированные растворы; насыщенный раствор.
Вещества, которые
диспергированы в растворе в виде молекул
– неэлектролиты.
Растворение – не чисто механический
процесс, связанный с простым дроблением
и вещества и его распределением в
растворе. При растворении происходит
уменьшение свободной энергии Гиббса
 ,
Растворение идёт до тех пор, пока не
наступит динамическое равновесие между
растворяемым веществом и растворителем,
т.е. пока
,
Растворение идёт до тех пор, пока не
наступит динамическое равновесие между
растворяемым веществом и растворителем,
т.е. пока
 .
Такой раствор называется насыщенный.
.
Такой раствор называется насыщенный.
-
В разбавленных растворах неэлектролитов можно пренебречь силами межмолекулярного взаимодействия между молекулами растворяемого вещества. Их можно рассматривать как результат механического смешивания компонентов, не сопровождающегося тепловым эффектом
( и
и
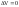 ).
).
Процесс самопроизвольного переноса вещества, приводящий к установлению равновесия концентрации, называется диффузией. Движущей энергией диффузии является стремление молекул обоих компонентов к равномерному распределению по всему объёму.
Односторонняя
диффузия через полупроницаемую мембрану
называют осмосом
(например, проникновение
 в сахарозу).
в сахарозу).
2.Оксиды, типы оксидов. Методы получения, химические свойства, номенклатура основных, кислотных, амфотерных.
Оксиды – это бинарные соединения, состоящие из двух химических элементов, один из которых кислород. Оксиды делят на основные, кислотные, амфотерные и несолеобразующие. В основе деления оксидов на указанные группы лежит их способность реагировать с кислотами и щелочами.
Основные оксиды – это оксиды, которые взаимодействуют с кислотами, образуя соль и воду. Основные оксиды образуют только металлы и при этом, как правило, они проявляют валентность I, II и реже III. Оксиды называют основными потому, что каждому из них соответствует основание. (Na2O – оксид натрия, соответствующее ему основание – NaOН; MgO – оксид магния, основание – Mg(OН)2.)
Главным свойством основных оксидов является их способность взаимодействовать с кислотами, образуя соль и воду: MgO + Н2SO4 = MgSO4 + Н2O; К2О + Н2SO4 = К2SO4 + Н2O.
Кислотные оксиды (или ангидриды) – это оксиды, которые взаимодействуют с основаниями, образуя соль и воду. Кислотные оксиды образованы кислородом и неметаллами, которые в кислотных оксидах проявляют высокую положительную степень окисления (+5, +6, +7), иногда металлами (Mn2O7). Каждому кислотному оксиду
соответствует кислота. (SO2 – оксид серы (IV) - Н2SO3 – сернистая кислота, SO3 – оксид серы (VI) - Н2SO4 – серная кислота)
Главным свойством кислотных оксидов является их способность взаимодействовать с основаниями, образуя соль и воду: SO3 + 2NaOH = Na2SO4 + Н2O;
Амфотерные оксиды – это оксиды, которые взаимодействуют как с кислотами, так и со щелочами. Амфотерный характер носят оксиды некоторых металлов II, III, IV и VI групп периодической системы элементов: ZnО – оксид цинка, Al2О3 – оксид алюминия, SnO – оксид олова (II) и некоторые другие. Амфотерные оксиды обладают свойствами и основных, и кислотных оксидов.
Взаимодействие амфотерного оксида с кислотой:ZnO + 2НCl = ZnCl2 + Н2O.
Взаимодействие амфотерного оксида с основанием: ZnO + NaOH + Н2O = Na2[Zn(OH)4].
Поскольку основные, кислотные и амфотерные оксиды образуют соли, все они являются солеобразующими оксидами.
Существует еще небольшая группа несолеобразующих (безразличых) оксидов. Это оксиды, для которых неизвестны соответствующие им кислоты или основания. К ним относятся: оксид азота (II) – NO, оксид углерода (II) – CO, оксид кремния (II) – SiO.
