
- •7. Правила заполнения электронами атомных орбиталей (принцип минимальной энергии, правило Клечковского, правила Паули и Гунда.)
- •Гидролиз солей: типы, константа и степень гидролиза.
- •Сильные (активность, коэффициент активности, ионная сила) электролиты.
- •Химические источники тока: гальванические элементы (эдс)
- •Пример - батарейка
- •Коррозия металлов: химическая
- •34. Понятие о комплексных соединениях: строение, номенклатура.
- •1.Основные законы и понятия в химии.
- •Константа воды. Водородный показатель (pH).
- •28. Окислительно-восстановительные реакции: степень окисления, окислитель и восстановитель (важнейшие окислители и восстановители), типы окислительно-восстановительных реакций.
- •Идеальные растворы. Растворы неэлектролитов: понятия диффузии и осмоса. Разбавленные и концентрированные растворы; насыщенный раствор.
- •2.Оксиды, типы оксидов. Методы получения, химические свойства, номенклатура основных, кислотных, амфотерных.
- •Буферные растворы.
1.Основные законы и понятия в химии.
Химия – это область естествознания, наука о веществах и их превращениях.
В XIX в. открыты 3 важных закона:
1.закон постоянства состава:
Состав
чистого вещества не зависит от способа
получения этого вещества. Т. е. для одной
и той же молекулы, например
 соотношение
соотношение
 и
и
 всегда постоянно.
всегда постоянно.
2.закон простых кратных отношений:
Если 2 элемента образуют друг с другом несколько соединений, то на одну и ту же массу одного из них приходятся такие массы другого, которые относятся между собой как небольшие целые числа.
3.закон простых объёмных отношений для реагирующих газов:
Объёмы реагирующих газов относятся друг к другу и к объёмам газообразных продуктов как небольшие целые числа.
Например,
один объём
 реагирует с двумя объёмами
реагирует с двумя объёмами
 и при этом получается точно 2 объёма
водяного пара:
и при этом получается точно 2 объёма
водяного пара:
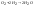 .
.
Основные понятия:
Молекула – наименьшая частица вещества, обладающая всеми его химическими свойствами.
Относительной
атомной массой
называется безразмерное число,
показывающее во сколько раз масса
данного атома больше чем 1/12 атома
изотопа углерода
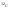 .
.
Число
Авогадро равно
 (благодаря
3 закону позволило
предположить, что в одинаковых объёмах
газов содержится одинаковое число
атомов, но не объясняли соотношение
объёмов продуктов реакции.
Выход
нашёл Авогадро в 1811 г., предположив, что
газообразные вещества состоят из
молекул, а не из атомов.)
(благодаря
3 закону позволило
предположить, что в одинаковых объёмах
газов содержится одинаковое число
атомов, но не объясняли соотношение
объёмов продуктов реакции.
Выход
нашёл Авогадро в 1811 г., предположив, что
газообразные вещества состоят из
молекул, а не из атомов.)
Количество частиц, равное числу Авогадро, получило название «моль».
Моль
– количество вещества, содержащего
столько же частиц (молекул, атомов,
ионов, электронов, фотонов) сколько
содержится атомов в 12 г изотопа
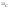 .
.
Масса 1-го моль называется молярной массой и выражается в [г/моль].
Из этого следует:
1.молекулярная масса, выраженная в г, равна относительной молекулярной массе в углеродной шкале
2.при одинаковых условиях 1 моль любого газа занимает один и тот же объём, равный 22,4 л.
-
Константа воды. Водородный показатель (pH).
Вода является слабым электролитом.

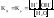
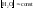
Концентрация воды
в разбавленных растворах электролитов
практически постоянная. Поэтому можно
считать постоянным и ионное произведение
воды.
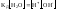
При

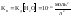 .При
увеличении температуры
.При
увеличении температуры
 возрастает.
возрастает.
В
любом водном растворе присутствуют
 и
и
 .
.
Кислотность и щёлочность среды обычно характеризуется концентрацией водородных ионов или водородным показателем pH
pH = 7 - нейтральный раствор
pH < 7 – кислотный раствор
pH > 7 – щёлочный раствор
Качественно определить реакцию среды можно с помощью индикатора.
