
- •7. Правила заполнения электронами атомных орбиталей (принцип минимальной энергии, правило Клечковского, правила Паули и Гунда.)
- •Гидролиз солей: типы, константа и степень гидролиза.
- •Сильные (активность, коэффициент активности, ионная сила) электролиты.
- •Химические источники тока: гальванические элементы (эдс)
- •Пример - батарейка
- •Коррозия металлов: химическая
- •34. Понятие о комплексных соединениях: строение, номенклатура.
- •1.Основные законы и понятия в химии.
- •Константа воды. Водородный показатель (pH).
- •28. Окислительно-восстановительные реакции: степень окисления, окислитель и восстановитель (важнейшие окислители и восстановители), типы окислительно-восстановительных реакций.
- •Идеальные растворы. Растворы неэлектролитов: понятия диффузии и осмоса. Разбавленные и концентрированные растворы; насыщенный раствор.
- •2.Оксиды, типы оксидов. Методы получения, химические свойства, номенклатура основных, кислотных, амфотерных.
- •Буферные растворы.
№ группы = указывает наивысшую положительную степень окисления
8–№ группы = указывает низшую отрицательную степень окисления
Реакции, протекающие с изменением степени окисления – окислительно-восстановительные реакции (ОВР).
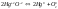 – ОВР
– ОВР
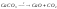 – не ОВР
– не ОВР
Окисление
– процесс отдачи электронов веществом,
т.е. повышение степени окисления элемента
(например:
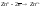 (с 0 до +2)).
(с 0 до +2)).
Вещества, отдающие
свои электроны в процессе реакции,
называются восстановителями
( из восстановленной формы в окисленную).
из восстановленной формы в окисленную).
К типичным
восстановителям относятся простые
вещества: металлы,
 ,
анионы, содержащие атомы с низкой
степени окисления.
,
анионы, содержащие атомы с низкой
степени окисления.
Восстановление
– процесс смещения электронов к
веществу, т.е. понижение степени окисления
элемента (например:
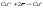 (с +2 до 0)).
(с +2 до 0)).
Вещества, принимающие
чужие электроны в процессе реакции,
называются окислителями
(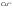 из окисленной формы в восстановленную).
из окисленной формы в восстановленную).
в восстановленную).
К типичным
окислителям относятся простые вещества,
атомы которых характеризуются высокой
электроотрицательностью: (галогены,
 ),
соединения
),
соединения
 (пероксиды), соединения благородных
газов (
(пероксиды), соединения благородных
газов (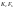 ),
катионы и анионы, содержащие атомы с
высокой степенью окисления (
),
катионы и анионы, содержащие атомы с
высокой степенью окисления (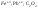 ).
).
Окисление и восстановление протекают как единый процесс:
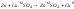
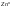 -восстановитель,
-восстановитель,
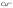 – окислитель.
– окислитель.
Число электронов, принимающих участие в окислении равно числу электронов, принимающих участие в восстановлении.
Существует 3 типа ОВР:
1.межмолекулярные
( );
);
-
2.внутримолекулярные (окислителем и восстановителем могут быть атомы одной и той же молекулы) (
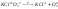 );
); -
3.диспропорционирования (окисление и восстановление атомов или ионов одного и того же элемента) (
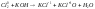 ).
).
-
28. Окислительно-восстановительные реакции: степень окисления, окислитель и восстановитель (важнейшие окислители и восстановители), типы окислительно-восстановительных реакций.
Для характеристики состояния элементов в соединениях введено понятие степени окисления. Степень окисления – воображаемый заряд атома в соединении, вычисляемый, исходя из предположения, что соединение состоит из ионов (+, –, 0).
-
1. Степень окисления элемента в простом веществе, например в Na или в
 равна 0.
равна 0. -
2. Степень окисления элемента в виде одноатомного иона в ионном соединении, например
 ,
,
 равна заряду данного иона.
равна заряду данного иона. -
3. В соединении с ковалентными полярными связями отрицательный заряд относят к более электроотрицательному элементу, причём применимы следующие степени окисления:
а.F = -1
b.O = -2 , исключение: пероксиды = -1; надпероксиды = - 1/2,; озониды = - 1/3;
c.H = +1 исключение солеобразующие гидриды LiH = -1
d.щелочные Me = + 1
-
e. Щелочноземельные Ме = +2
Произведение растворимости.
Применение закона
действующих масс к гетерогенной системе,
в которой находятся и осадок и раствор
в равновесии:
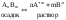 даёт выражение константы
даёт выражение константы
равновесия:
 (произведение
растворимости).
(произведение
растворимости).
Таким образом, в насыщенном растворе малорастворимого электролита произведение концентраций его ионов, возведённых в степень с показателем, равным стехиометрическому коэффициенту при данном ионе, при данной температуре – величина постоянная.
Произведение
растворимости
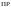 ,
как и коэффициент диссоциации
,
как и коэффициент диссоциации
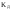 зависит от природы растворённого
вещества, природы растворителя и
температуры.
зависит от природы растворённого
вещества, природы растворителя и
температуры.
Произведение
растворимости
 характеризует сравнительную растворимость
однотипных веществ: чем больше
произведение растворимости данного
вещества, тем больше его растворимость.
характеризует сравнительную растворимость
однотипных веществ: чем больше
произведение растворимости данного
вещества, тем больше его растворимость.
13
Топливные элементы – элементы, в которых окислитель и восстановитель хранятся вне элемента и в процессе работы раздельно подаются к электродам, которые не расходуются.
Удельная энергия топливных элементов значительно выше удельной энергии гальванических элементов.
В топливных
элементах используются жидкие или
газообразные восстановители ( ,
,
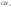 ,
,
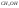 )
и окислители (обычно
)
и окислители (обычно
 воздуха).
воздуха).
В отличие от гальванических элементов, топливные элементы не могут работать без вспомогательных устройств.
Электрохимическая энергоустановка – установка, состоящая из:
-
- батареи топливных элементов,
-
- системы хранения, обработки и подвода топлива и окислителя,
-
- системы отвода продуктов реакции,
-
- системы поддержания и регулирования температуры в элементах,
-
- преобразователя тока и напряжения.
Аккумуляторы – устройства, в которых электрическая энергия превращается в химическую энергию, а химическая – снова в электрическую. а процесс превращения химической энергии в электрическую – разрядом аккумулятора.
При заряде аккумулятор работает как электролизёр, при разряде – как гальванический элемент.
-
Процесс заряда-разряда аккумулятора осуществляется многократно.
-
Наиболее распространёнными являются свинцовые аккумуляторы, в которых в качестве электродов используются
 -решётки,
а в качестве электролита – раствор
-решётки,
а в качестве электролита – раствор
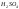 и дистиллированной
и дистиллированной
 (поэтому они ещё называются кислотными
аккумуляторами).
(поэтому они ещё называются кислотными
аккумуляторами).
 -решётки
вначале заполняются
-решётки
вначале заполняются
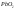 ,
который при взаимодействии с
,
который при взаимодействии с
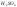 превращается в
превращается в
 .
Электроды разделяются друг от друга
раствором
.
Электроды разделяются друг от друга
раствором
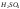 и сепараторами. Аккумуляторы соединяют
в батарею, которую помещают в баки из
эбонита или полипропилена.
и сепараторами. Аккумуляторы соединяют
в батарею, которую помещают в баки из
эбонита или полипропилена.
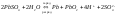 (суммарная реакция)
(суммарная реакция)
14
14
Гибридизация
атомных орбиталей. -
и -связи:
При участии в образовании -связей
орбиталей разных типов, например, в
молекуле
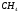 следовало бы ожидать формирование
связей, отличающихся друг от друга по
длине и прочности. Однако все связи
следовало бы ожидать формирование
связей, отличающихся друг от друга по
длине и прочности. Однако все связи
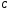 −
−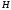 равноценны и располагаются симметрично
друг другу. В рамках МВС эти факты
объясняются на основе концепции
гибридизации атомных валентных
орбиталей.
Согласно ей в валентных состояниях
электроны распределяются не на чистых
S
и P
орбиталях, а на смешанных (гибридных).
Число гибридных равно числу атомных
орбиталей. Гибридные орбитали одинаковы
по форме и энергии. В отличии от атомных
орбиталей гибридные более вытянуты в
направлении образования химической
связи.
равноценны и располагаются симметрично
друг другу. В рамках МВС эти факты
объясняются на основе концепции
гибридизации атомных валентных
орбиталей.
Согласно ей в валентных состояниях
электроны распределяются не на чистых
S
и P
орбиталях, а на смешанных (гибридных).
Число гибридных равно числу атомных
орбиталей. Гибридные орбитали одинаковы
по форме и энергии. В отличии от атомных
орбиталей гибридные более вытянуты в
направлении образования химической
связи.
Типы гибридизаций:
SP3 – гибридизация – при взаимодействии 1S и 3P орбиталей,
SP2 – гибридизация – при взаимодействии 1S и 2P орбиталей,
SP – гибридизация – при взаимодействии 1S и 1P орбиталей
Доля s-орбитали составляет:
SP- гибридизации – 50%,
SP2-
гибридизации – 34%,SP3-
гибридизации – 25%.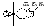
15
25
Энергия активации (активированный комплекс, энергетические диаграммы экзо- и эндотермических реакций, влияние катализаторов, уравнение Аррениуса). Катализ (гомогенный и гетерогенный; ферменты, промоторы, ингибиторы).
Не всякое столкновение молекул сопровождается их взаимодействием. Большинство молекул отскакивают как упругие шарики. И только активные при столкновении взаимодействуют друг с другом. Активные молекулы обладают некоторой избыточной Е по сравнению с неактивными молекулами, поэтому в активных молекулах связи между ними ослаблены.
Активированный комплекс

Энергия для перевода
молекулы в активное состояние – энергия
активации
 .
Чем она меньше, тем больше частиц
реагируют, тем больше скорость химической
реакции.
.
Чем она меньше, тем больше частиц
реагируют, тем больше скорость химической
реакции.
Изменение Е в ходе реакции:
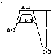
Е выделяется (экзотермическая)
С
увеличением температуры число активных
молекул растёт, поэтому
 увеличивается.
увеличивается.
Константа
 химической реакции связана с
химической реакции связана с
 :
:
 ,
где А – предэкспоненциальный множитель
(связан с вероятностью и числом
столкновений).
,
где А – предэкспоненциальный множитель
(связан с вероятностью и числом
столкновений).
Одним из наиболее
распространённых в химической практике
методов ускорения химических реакций
является катализ.
Катализаторы
– вещества, изменяющие
 химической реакции за счёт участия в
промежуточном химическом взаимодействии
с компонентами реакции, но восстанавливающие
после каждого цикла промежуточного
взаимодействия свой химический состав.
химической реакции за счёт участия в
промежуточном химическом взаимодействии
с компонентами реакции, но восстанавливающие
после каждого цикла промежуточного
взаимодействия свой химический состав.
промежуточном химическом взаимодействии с компонентами реакции, но восстанавливающие после каждого цикла промежуточного взаимодействия свой химический состав.
Существуют 2 вида катализаторов:
Гомокатализаторы (окислениеСО)
Гетерокатализаторы (окисление SO2 до SO3)
Биологические катализаторы – ферменты.
Ингибиторы
– вещества, замедляющие
 химической реакции.
химической реакции.
Промоторы – вещества, усиливающие действие катализаторов.
25
25
27
27
27
