
- •7. Правила заполнения электронами атомных орбиталей (принцип минимальной энергии, правило Клечковского, правила Паули и Гунда.)
- •Гидролиз солей: типы, константа и степень гидролиза.
- •Сильные (активность, коэффициент активности, ионная сила) электролиты.
- •Химические источники тока: гальванические элементы (эдс)
- •Пример - батарейка
- •Коррозия металлов: химическая
- •34. Понятие о комплексных соединениях: строение, номенклатура.
- •1.Основные законы и понятия в химии.
- •Константа воды. Водородный показатель (pH).
- •28. Окислительно-восстановительные реакции: степень окисления, окислитель и восстановитель (важнейшие окислители и восстановители), типы окислительно-восстановительных реакций.
- •Идеальные растворы. Растворы неэлектролитов: понятия диффузии и осмоса. Разбавленные и концентрированные растворы; насыщенный раствор.
- •2.Оксиды, типы оксидов. Методы получения, химические свойства, номенклатура основных, кислотных, амфотерных.
- •Буферные растворы.
-
Гидролиз солей: типы, константа и степень гидролиза.
Гидролиз солей
– взаимодействие ионов соли с водой,
приводящие к образованию слабого
электролита. Гидролиз характеризуется
степенью
гидролиза h
и константой
гидролиза
 .
.
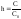 ,
где C
–количество гидролизующихся молекул,
,
где C
–количество гидролизующихся молекул,
 –
общее число молекул
–
общее число молекул
Различают 3 типа гидролиза солей:
-
1. гидролиз по катиону (+) – соли, образованные сильной кислотой и слабым основанием (
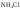 ,
,
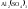 ,
,
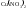 )
)
Например,
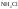 :
:
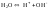 (1)
(1)
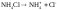 (2)
(2)
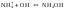 (3)
(3)
(1)+(3)
т. е.
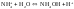 (4)
(4)
-
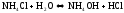 (5) молярный вид
(5) молярный вид
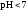
-
для (4)
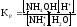 (6)
(6) -
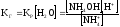 (7)
(7) -
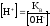 подставим в (6)
подставим в (6) -
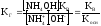 ,
т.к.
,
т.к.
-
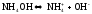
-
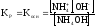
-
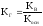
-
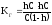 по (7) и (4)
по (7) и (4)
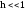
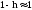
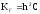
-
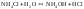 (5) молекулярный
вид
(5) молекулярный
вид
В
этом случае pH
< 7 – кислая, т.к происходит накопление
ионов
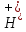 .
.
для
(4)
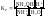 (6)
(6)
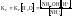 (7)
(7)
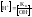 подставим в (6)
подставим в (6)

,
т.к.
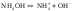
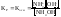

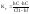 по (7) и (4)
по (7) и (4)

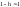
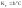
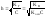
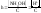
2. гидролиз по аниону (-) – соли, образованные слабой кислотой и сильным основанием
Например,

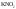
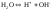 (1)
(1)
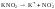 (2)
(2)
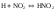 (3)
(3)
(1)+(3)
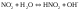 (4)
(4)
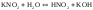 (5)
(5)
Тогда:
 ,
,

3. гидролиз по аниону и катиону (+ и -) – соли, образованные слабой кислотой и слабым основанием
Например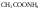
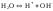 (1)
(1)
 (2)
(2)
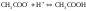 (3)
(3)
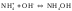 (4)
(4)
В
этом случае:
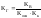 ,
,

Метод валентных связей
Ковалентная связь – тип химической связи между атомами, возникающей при обобществлении электронов, которые принадлежат этим атомам.
Согласно
методу
валентных связей
ковалентная связь образуется не путем
передачи, а путем обобществления
неспаренных электронов с антипараллельными
спинами по 1-му от каждого атома.
Образовавшаяся в этом случае электронная
пара принадлежит обоим атомам.
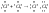 Сl
– Cl
– обозначение ковалентной связи.
Сl
– Cl
– обозначение ковалентной связи.
Чем в большей степени перекрываются атомные орбитали, тем прочнее связь.
Перекрывание атомных орбиталей возможно лишь при их определенной взаимной ориентации в пространстве.
Ковалентная связь в отличие от ионной имеет направленность.
3
-
Сильные (активность, коэффициент активности, ионная сила) электролиты.
Отношение числа
распавшихся молекул на ионы к общему
числу молекул в растворе называется
степенью
диссоциации:
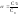 .
.
По склонности к диссоциации электролиты делятся на:
сильные
( )
и
слабые
(
)
и
слабые
(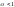 ).
).
-
К сильным электролитам относятся:
-
Практически все соли
-
Ряд неорганических кислот (HF, HCL, HBr, HJ,
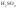 ,
,
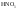 )
) -
Гидроксиды металлов 1-ой и 2-ой группы
В сильных электролитах
степень диссоциации
 ,
поэтому имеет место высокая концентрация
заряжённых частиц. Естественно они
взаимодействуют друг с другом. Это
связывание ионов понижает концентрацию
ионов. Такое явление называется
активностью:
a
= fC,
где
,
поэтому имеет место высокая концентрация
заряжённых частиц. Естественно они
взаимодействуют друг с другом. Это
связывание ионов понижает концентрацию
ионов. Такое явление называется
активностью:
a
= fC,
где
f–коэффициент активности, C–концентрация
Для очень разбавленных растворов коэффициент активности f = 1 (взаимодействия нет), т.е. a = C.
Активность a зависит от заряда иона и ионной силы.
Ионная
сила раствора
 – это полусумма произведений концентраций
всех находящихся в растворе ионов на
квадрат их заряда:
– это полусумма произведений концентраций
всех находящихся в растворе ионов на
квадрат их заряда:
 .
.

3
3
Типы химической связи: ионная
Для объяснения ионной связи необходимо уяснить себе следующие понятия:
Потенциал ионизации – энергия, которую необходимо затратить для удаления 1-го электрона с внешней орбитали, при этом атом переходит из нейтрального в положительно заряженный ион (катион).
Чем меньше потенциал ионизации, тем легче атом теряет электроны, тем сильнее выражены у электрона металлические свойства. Потенциал ионизации растет в пределах периода слева направо, уменьшается сверху вниз.
Атом
может не только терять электроны, но и
присоединять. Энергия, которая выделяется
при присоединении электронов к атому,
называется сродством
к электрону.
Чем больше эта энергия, тем более
неметалл этот элемент. Сродство к
электрону увеличивается слева направо,
уменьшается сверху вниз. Условная
величина, характеризующая способность
атома притягивать к себе электроны
называется электроотрицательностью.
Она равна полусумме потенциала ионизации
и энергии сродства к электрону:
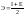 (
( ядра). Электроотрицательность растет
слева направо и уменьшается сверху
вниз (увеличение числа электронных
оболочек). Наиболее электроотрицательный
элемент –
F.
ядра). Электроотрицательность растет
слева направо и уменьшается сверху
вниз (увеличение числа электронных
оболочек). Наиболее электроотрицательный
элемент –
F.
Ионная связь образуется между элементами сильно отличающимися по электроотрицательности, а именно Э1,9. Ионная связь образуется за счет перехода одного или нескольких электронов от одного
атома на внешнюю оболочку другого атома.
Атом, отдавший
электрон становится положительно
заряженным, а получивший – отрицательно
заряженный.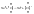
Образование ионной связи происходит по октаэдрическому правилу. Согласно этому правилу атом принимает, теряет или разделяет электроны таким образом, чтобы электронное облако для него соответствовало ближайшему инертному газу.
1S22S22P63S1
( )
1S22S22P63S23P5
(
)
1S22S22P63S23P5
( )
)
Ионная связь наиболее характерна для неорганических соединений.
Атом,
отдавший электрон становится положительно
заряженным, а получивший – отрицательно
заряженный.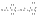
Образование ионной связи происходит по октаэдрическому правилу. Согласно этому правилу атом принимает, теряет или разделяет электроны таким образом, чтобы электронное облако для него соответствовало ближайшему инертному газу.
1S22S22P63S1
( )
1S22S22P63S23P5
(
)
1S22S22P63S23P5
( )
)
Ионная связь наиболее характерна для неорганических соединений.
Понятие раствора. Способы выражения состава раствора (массовая доля, молярность, моляльность, нормальность).
Раствор – газообразная, твёрдая или жидкая гомогенная система состоящая из 2-х или более элементов относительное содержание которых может изменяться в неограниченных пределах. Он состоит из растворённого вещества и растворителя, в котором это вещество равномерно распределено в виде молекул и ионов.
Важной характеристикой любого раствора является его состав, который выражается концентрацией.
Массовая
доля –
отношение массы растворённого вещества
X
к общей массе раствора m
:
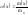 (обычно выражается в процентах %)
(обычно выражается в процентах %)
-
Мольная доля – отношение количества растворённого вещества X к сумме количеств всех компонентов в растворе:
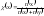 ,
где
,
где
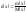 – молярная масса для 2-х компонентов.
– молярная масса для 2-х компонентов.
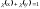
4
4
5
5
4
4
4
-
Молярная концентрация – отношение количества растворённого вещества к объёму раствора:
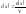 (выражается в
(выражается в
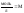 ,
например, 2 М
,
например, 2 М
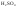 ,
в единице раствора 2 моля
,
в единице раствора 2 моля
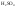 ).
).
Эквивалентная (нормальная) концентрация – отношение количества эквивалентов растворённого вещества к объёму раствора:
-
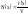 (выражается в
(выражается в
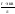 )
) -
Химическим эквивалентом называется некоторая условная или реальная частица, которая может в реакциях присоединить или высвободить 1 ион водорода:
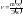 ,
где
,
где
 – эквивалентная масса
– эквивалентная масса

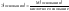
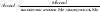
-
Моляльная концентрация – отношение количества растворённого вещества к массе растворителя:
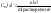 (выражается в
(выражается в
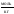 ).
).
химическую связь можно определить как взаимодействие атомов, обусловленное перекрыванием их электронных облаков, и сопровождается уменьшением полной энергии системы.
Металлическая связь. При обычных условиях металлы, за исключением ртути Hg, существуют в виде кристаллов. Взаимодействие, удерживающее атомы металлов в едином кристалле, называется металлической связью.
Природа металлической связи подобна ковалентной связи: оба типа связи основаны на обобществлении валентных электронов. Однако в атомах металлов количество таких электронов меньше количества вакантных орбиталей. Электроны слабо удерживаются ядром. Поэтому они могут переходить из одной орбитали в другую. Стремясь принять более устойчивое состояние
Благодаря свободному перемещению электронов металлы обладают высокой электрической проводимостью и теплопроводностью. По прочности металлическая связь меньше ковалентной связи в 3-4 раза.
Водородная связь – одна из разновидностей межмолекулярного взаимодействия.
Когда очень электроотрицательный атом (O,N,S) связан с атомом H, последний в результате смещения электронной пары ковалентной связи к наиболее электроотрицательному атому становится настолько
электроно-дефицитным, что начинает проявлять остаточное сродство к электрону и поэтому он способен образовывать донорную связь:
Различают водородную связь: межмолекулярную и внутримолекулярную. Энергия водородной связи на 1, 2 порядка меньше энергии ковалентной связи.
Энергия связи – энергия, которую надо затратить, чтобы разорвать химическую связь. Тоже количество энергии выделяется при образовании химической связи. С увеличением кратности связи, энергия увеличивается.
5
Жесткость воды:
Растворимые соли Са и Мg обусловливают жесткость воды. Различают временную и постоянную жесткость воды. Временная (карбонатная) жесткость воды связана с наличием в воде растворимых гидрокарбонатов Са и Мg. Ее устраняют нагреванием:
Са(НСО3)2 = СаСО3 +СО2 + Н2О
или добавлением известковой воды:
Са(НСО3)2 + Са(ОН)2 = 2СаСО3 + 2Н2О.
Постоянная жесткость обусловлена наличием в растворе Са- и Мg-солей сильных кислот – сульфатов, хлоридов. Кипячением она не устраняется. Постоянная жесткость удаляется добавлением соды: CaSO4 + Na2CO3 = СаСО3 + Na2SO4.
Степень жесткости воды выражается числом миллиэквивалентов (мэкв) ионов Са2+ и Мg2+, содержащихся в 1 л воды:
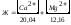 ,
(мэкв/л)
,
(мэкв/л)
где [Ca2+] и [Mg2+] – концентрация ионов Ca2+ и Mg2+ (мг/л).
Скорость реакции и факторы, влияющие на нее.
Под скоростью химической реакции понимают число элементарных актов реакции, проходящих в единицу времени в единице объёма (для гомогенных реакций) и на единицу поверхности (для гетерогенных реакций).
Так как при реакции
изменяется концентрация реагирующих
веществ, то скорость обычно определяют
как изменение концентрации реагентов
в единицу времени и выражают в моль/л∙сек.
При этом нет необходимости следить за
изменением концентрации всех веществ,
входящих в реакцию, поскольку
стехиометрический коэффициент в
уравнении реакции устанавливает
соотношение между концентрациями, т.е.
при
 скорость накопления аммиака вдвое
больше скорости расходования водорода.
скорость накопления аммиака вдвое
больше скорости расходования водорода.
Скорость химических реакций зависит:
-
от природы реагирующих веществ, от концентрации реагентов, от катализатора, от температуры, от степени измельчения твёрдого вещества (гетерогенные реакции), от среды (растворы), от формы реактора (цепные реакции), от освещения (фотохимические реакции)
Основной
закон химической кинетики – закон
действующих масс:
скорость химической реакции пропорциональна
произведению концентраций реагирующих
веществ в реакции
 :
:
6
