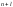- •7. Правила заполнения электронами атомных орбиталей (принцип минимальной энергии, правило Клечковского, правила Паули и Гунда.)
- •Гидролиз солей: типы, константа и степень гидролиза.
- •Сильные (активность, коэффициент активности, ионная сила) электролиты.
- •Химические источники тока: гальванические элементы (эдс)
- •Пример - батарейка
- •Коррозия металлов: химическая
- •34. Понятие о комплексных соединениях: строение, номенклатура.
- •1.Основные законы и понятия в химии.
- •Константа воды. Водородный показатель (pH).
- •28. Окислительно-восстановительные реакции: степень окисления, окислитель и восстановитель (важнейшие окислители и восстановители), типы окислительно-восстановительных реакций.
- •Идеальные растворы. Растворы неэлектролитов: понятия диффузии и осмоса. Разбавленные и концентрированные растворы; насыщенный раствор.
- •2.Оксиды, типы оксидов. Методы получения, химические свойства, номенклатура основных, кислотных, амфотерных.
- •Буферные растворы.
Для описания
стоячей волны, образованной в атоме
движущимся электроном, т.е. для нахождения
волновой функции
 необходимы квантовые
числа.
необходимы квантовые
числа.
1.Главное квантовое
число
 характеризует удалённость электрона
от ядра и определяет его энергию (чем
больше
характеризует удалённость электрона
от ядра и определяет его энергию (чем
больше
 ,
тем больше энергия электрона и тем
меньше энергия связи с ядром).
,
тем больше энергия электрона и тем
меньше энергия связи с ядром).
 принимает целочисленные значения от
1 до
принимает целочисленные значения от
1 до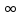 .
.
Состояние электрона
характеризующееся различными значениями
главного квантового числа
 ,
называется
электронным слоем
(электронной
оболочкой,
энергетическим
уровнем).
Они обозначаются цифрами 1, 2, 3, 4, 5, …
,
называется
электронным слоем
(электронной
оболочкой,
энергетическим
уровнем).
Они обозначаются цифрами 1, 2, 3, 4, 5, …
Квантовое состояние
атома с наименьшей энергией – основное
состояние,
а с более высокой – возбуждённое
состояние.
Переход электрона с одного уровня на
другой сопровождается либо поглощением,
либо выделением энергии:
 .
.
2.Побочное квантовое
(орбитальное, азимутальное) число
 (принимает все целочисленные значения
от 0 до (n-1)).
(принимает все целочисленные значения
от 0 до (n-1)).
Состояние электрона характеризующееся различными значениями
побочного
квантового числа
 называется энергетическим
подуровнем.
называется энергетическим
подуровнем.
В
пределах каждого уровня с увеличением
 ,
растёт энергия орбитали.
,
растёт энергия орбитали.
3.Магнитное
квантовое число
 характеризует ориентацию орбитали в
пространстве (принимает все целочисленные
значения от -
характеризует ориентацию орбитали в
пространстве (принимает все целочисленные
значения от - до +
до + ).
).
4.Спиновое квантовое
число
 характеризует вращательный момент,
который приобретает электрон в результате
собственного вращения вокруг своей
оси (принимает два значения:
характеризует вращательный момент,
который приобретает электрон в результате
собственного вращения вокруг своей
оси (принимает два значения:
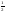 – вращение по часовой стрелке,
– вращение по часовой стрелке,
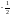 – вращение против часовой стрелки).
– вращение против часовой стрелки).
(p-элементы) У этих элементов заполняется внешний p-подуровень. Валентными у них является не только p-, но и s-электроны. Высшая степень окисления - № групп.
5а подгруппа: N, P, As, Sb, Bi. Степень окисления +3; +5; -3. В группе сверху вниз металлические свойства усиливаются. Bi – типичный металл. ns2p3
Азот.Азот – не поддерживающий дыхания. При обычных условиях азот – газ без цвета и запаха. Нахождение в природе:По объему много в атмосфере – 78,09%; в земной коре в виде минералов. Ионы CN-, NO3-, NH4+(натриевая селитра NaNO3) Участвует в различных процессах жизнедеятельности, в термоядерных реакциях на Солнце, присутствует в белках,. Азот переводится клубеньковыми бактериями в соединения. Степень окисления от -3 до +5.3 неспаренных электрона в NH4+
Ионное состояние в нитрогруппе. Молекула азота двухатомная NN.
Получение: в промышленности из воздуха, в лабораторных условиях из NH4NO2N2+2H2O; (NH4)2Cr2O7N2+4H2O+Сr2O3
Химические свойства. Азот инертен.
N2+O2=NO\NH3+O2N2+H2O\NH3+Cl2N2+NH4Cl\NH3+NaNaNH2+H2. В образовании связей участвуют 2р-электрона и 2s-электрона, неподеленная пара способна образовывать водородные связи
Аммиак обладает основными свойствами:
NH3+HClNH4Cl; NH3+Н2ONH4ОН; CuO+ NH3Cu+N2+H2O
Оксиды азота. N2+1O-закись азота (веселящий газ),
N+2O - бесцветный газ.N2+3О3; N+4O2; N2+5О5 – кислотные.
N2О3 – красно-бурый газ, соли – нитриты.
NO2 – бурый газ с удушливым запахом. NO2+H2ONH2+HNO3 , NO2 – сильный окислитель.N2О5 – единственный твердый оксид при обычной температуре, бесцветные кристаллы. N2О5+H2OHNO3
1 часть HNO3 + 3 части HCl царская водка.Все соли азотистой кислоты ядовиты.
Азотная кислота. При нагревании и под действием света разлагается. С водой смешивается в любых отношениях. Обладает сильными окислительными свойствами. Большинство металлов превращается концентрированной азотной кислотой в соответствующие оксиды или нитраты. Устойчивы к действию азотной кислоты Pt, Rh родий, Ir, Ta, Au.
Концентрированная HNO3 энергично действует на неметаллы:
HNO3+SH2SO4 \HNO3+PH3PO4\HNO3+AsH3AsO4\HNO3+I2HIO3
Фосфор. Электронная формула 3s23p3. В переводе с греческого – концентрирующий свет, светится в темноте. Благодаря высокой реакционной способности в природе не встречается. Фосфор входит в состав белков, ферментов, витаминов. Наиболее характерны степени окисления: +5 - Н3РО4, +3 – PCl3; -3 – РН3. МЫШЬЯК, СУРЬМА, ВИСМУТ – проявляют металлические свойства. В природе встречаются в виде сульфидов. Оксид мышьяка, как N и Р – кислотный. Оксид сурьмы (III) является амфотерным, оксид сурьмы (V) – кислотным, оксид висмута(III) – основным.
температуре, бесцветные кристаллы. N2О5+H2OHNO3
1 часть HNO3 + 3 части HCl царская водка.Все соли азотистой кислоты ядовиты.
Азотная кислота. При нагревании и под действием света разлагается. С водой смешивается в любых отношениях. Обладает сильными окислительными свойствами. Большинство металлов превращается концентрированной азотной кислотой в соответствующие оксиды или нитраты. Устойчивы к действию азотной кислоты Pt, Rh родий, Ir, Ta, Au.
Концентрированная HNO3 энергично действует на неметаллы:
HNO3+SH2SO4 \HNO3+PH3PO4\HNO3+AsH3AsO4\HNO3+I2HIO3
Фосфор. Электронная формула 3s23p3. В переводе с греческого – концентрирующий свет, светится в темноте. Благодаря высокой реакционной способности в природе не встречается. Фосфор входит в состав белков, ферментов, витаминов. Наиболее характерны степени окисления: +5 - Н3РО4, +3 – PCl3; -3 – РН3. МЫШЬЯК, СУРЬМА, ВИСМУТ – проявляют металлические свойства. В природе встречаются в виде сульфидов. Оксид мышьяка, как N и Р – кислотный. Оксид сурьмы (III) является амфотерным, оксид сурьмы (V) – кислотным, оксид висмута(III) – основным.
В
пределах каждого уровня с увеличением
 ,
растёт энергия орбитали.
,
растёт энергия орбитали.
3.Магнитное
квантовое число
 характеризует ориентацию орбитали в
пространстве (принимает все целочисленные
значения от -
характеризует ориентацию орбитали в
пространстве (принимает все целочисленные
значения от - до +
до + ).
).
4.Спиновое квантовое
число
 характеризует вращательный момент,
который приобретает электрон в результате
собственного вращения вокруг своей
оси (принимает два значения:
характеризует вращательный момент,
который приобретает электрон в результате
собственного вращения вокруг своей
оси (принимает два значения:
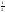 – вращение по часовой стрелке,
– вращение по часовой стрелке,
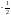 – вращение против часовой стрелки).
– вращение против часовой стрелки).
7. Правила заполнения электронами атомных орбиталей (принцип минимальной энергии, правило Клечковского, правила Паули и Гунда.)
Атомные орбитали заполняются электронами в соответствии с 3-мя принципами:
1.Принцип устойчивости (принцип min энергии): Каждая новая орбиталь заполняется только после того, как будут заполнены все предыдущие, т.е. более устойчивые (с min энергией) орбитали.
Энергия атомных орбиталей возрастает следующим образом:

|
|
|
|
Орбиталь |
|
1 |
0 |
1 |
1s |
|
2 |
0 |
2 |
2s |
|
1 |
3 |
2p |
|
|
3 |
0 |
3 |
3s |
|
1 |
4 |
3p |
|
|
2 |
5 |
3d |
|
|
4 |
0 |
4 |
4s |
|
1 |
5 |
4p |
|
|
2 |
6 |
4d |
|
|
3 |
7 |
4f |
|
|
5 |
0 |
5 |
5s |
|
1 |
6 |
5p |
|
|
2 |
7 |
5d |
|
|
3 |
8 |
5f |
|
|
4 |
9 |
5g |
|
|
|
|||
2.Принцип Паули:
в атоме не может быть 2 электрона, у
которых 4 одинаковых квантовых числа.
Следовательно, на 1-ой орбитали могут
находиться не более 2-х электронов,
отличающихся друг от друга значением
спинового квантового числа. Отсюда
следует, что максимальное количество
электронов на энергетическом уровне
 ,
на энергетическом подуровне
,
на энергетическом подуровне
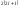 .
.
Пример:



3.Правило Хунда: электроны располагаются на орбиталях равной энергии таким образом, чтобы их суммарный спин был максимальный. Это означает, что первоначально электроны заполняют все свободные орбитали данного подуровня по 1-му, имея при этом параллельные спины, и только потом происходит заполнение этих орбиталей 2-ми электронами.
Количество неспаренных электронов на внешнем уровне определяет валентность элемента, т.е. способность образовывать химические связи с другими атомами. В большинстве случаев, но не всегда.
1
1
1
2
2
1
2
2
2
2
2
1
Правила заполнения электронами атомных орбиталей (принцип минимальной энергии, правило Клечковского, правила Паули и Гунда.)
Атомные орбитали заполняются электронами в соответствии с 3-мя принципами:
1.Принцип устойчивости (принцип min энергии): Каждая новая орбиталь заполняется только после того, как будут заполнены все предыдущие, т.е. более устойчивые (с min энергией) орбитали.
Энергия атомных орбиталей возрастает следующим образом:

Правило
Клечковского:
заполнение электронами атомных орбиталей
происходит в соответствии с увеличением
суммы главного
 и побочного
и побочного
 квантовых чисел; если
квантовых чисел; если
 одинакова, то атомная орбиталь заполняется
от больших
одинакова, то атомная орбиталь заполняется
от больших
 и меньших
и меньших
 к меньшим
к меньшим
 и большим
и большим
 .
.