
- •7. Правила заполнения электронами атомных орбиталей (принцип минимальной энергии, правило Клечковского, правила Паули и Гунда.)
- •Гидролиз солей: типы, константа и степень гидролиза.
- •Сильные (активность, коэффициент активности, ионная сила) электролиты.
- •Химические источники тока: гальванические элементы (эдс)
- •Пример - батарейка
- •Коррозия металлов: химическая
- •34. Понятие о комплексных соединениях: строение, номенклатура.
- •1.Основные законы и понятия в химии.
- •Константа воды. Водородный показатель (pH).
- •28. Окислительно-восстановительные реакции: степень окисления, окислитель и восстановитель (важнейшие окислители и восстановители), типы окислительно-восстановительных реакций.
- •Идеальные растворы. Растворы неэлектролитов: понятия диффузии и осмоса. Разбавленные и концентрированные растворы; насыщенный раствор.
- •2.Оксиды, типы оксидов. Методы получения, химические свойства, номенклатура основных, кислотных, амфотерных.
- •Буферные растворы.
-
 ,
где k
– постоянная скорости химической
реакции
,
где k
– постоянная скорости химической
реакции -
Физический смысл
 при
при
 .
. -
Если в реакции участвуют не 2-е частицы, а более
 ,
то:
,
то:
 ~
~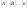 в степенях, равных стехиометрическим
коэффициентам, т.е.:
в степенях, равных стехиометрическим
коэффициентам, т.е.:
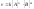 ,
где
,
где -
 – показатель
порядка реакции в целом (реакции
первого, второго, третьего … порядков).
– показатель
порядка реакции в целом (реакции
первого, второго, третьего … порядков). -
Число частиц, участвующих в этом акте реакции определяет молекулярность реакции:
 мономолекулярная
(
мономолекулярная
( )
)
 бимолекулярная(
бимолекулярная( )
)
 тримолекулярная
тримолекулярная
Больше 3-х не бывает, т.к. столкновение – маловероятно.
Зависимость
скорости реакции от температуры
определяется эмпирическим правилом
Вант-Гоффа:
при увеличении температуры на
 ,
скорость химической реакции увеличивается
в 2 – 4 раза
,
скорость химической реакции увеличивается
в 2 – 4 раза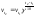
6
-
Химические источники тока: гальванические элементы (эдс)
-
Пример - батарейка
Гальванический
элемент:
система, где 2 элемента находятся в
растворах собственных ионов ( -пластина
погружена в раствор
-пластина
погружена в раствор
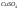 и
и
 -пластина
погружена в раствор
-пластина
погружена в раствор
 ).
).
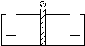
Для предотвращения прямого взаимодействия окислителя и восстановителя электроды отделены друг от друга пористой перегородкой.
На поверхности
 -пластины
возникает 2-ой электронный слой и
устанавливается равновесие
-пластины
возникает 2-ой электронный слой и
устанавливается равновесие
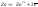 ,
также и на поверхности
,
также и на поверхности
 -пластины
возникает 2-ой электронный слой и
устанавливается равновесие
-пластины
возникает 2-ой электронный слой и
устанавливается равновесие
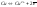 .
Возникают
.
Возникают
потенциалы
у
 и
и
 .
.
При замыкании внешней цепи происходят процессы самопроизвольного растворения Zn и выделения Cu (потенциал Zn-электрода имеет более отрицательное значение, чем потенциал Cu-электрода, поэтому при замыкании внешней цепи, электроны будут переходить от Zn к Cu). Процессы идут до тех пор, пока не выровняются потенциалы или не растворится Zn.
6
6
7
7
8
8
8
химическую связь можно определить как взаимодействие атомов, обусловленное перекрыванием их электронных облаков, и сопровождается уменьшением полной энергии системы.
Координационная связь – (донорно-акцепторная) может рассматриваться, как результат наложения ионных и ковалентных связей.
Координационная связь как и ковалентная связь обладает определенной жесткостью, однако атомы, образующие эту связь несут на себе q как в ионной связи. При образовании координационной связи атомы приобретают заряды. Образование координационной связи происходит в результате обобщения пары электронов, принадлежащих только одному атому – донору, в то время как второй является акцептором, имеющим свободную орбиталь.
-
Коррозия металлов: химическая
-
Коррозия — это разрушение металла в результате его физико-химического взаимодействия с окружающей средой. При этом металлы окисляются и образуются продукты, состав которых зависит от условий коррозии.
По механизму протекания коррозионного процесса, зависящему от характера внешней среды, с которой взаимодействует металл, различают химическую и электрохимическую коррозию.
Химическая коррозия характерна для сред, не проводящих электрический ток. При химической коррозии происходит прямое гетерогенное взаимодействие металла с окислителем окружающей среды. По условиям протекания коррозионного процесса различают:
а) газовую коррозию - в газах и парах без конденсации влаги на поверхности металла, обычно при высоких температурах. Примером
газовой коррозии может служить окисление металла кислородом воздуха при высоких температурах;
б) коррозию в неэлектролитах — агрессивных органических жидкостях, таких, как сернистая нефть и др.
ВМС – соединения, состоящие из молекул больших размеров и молекулярной массы. К ним относятся соединения полимерного и неполимерного строения. Полимеры состоят из многократно повторяющихся элементарных звеньев – мономеров. Если число звеньев до 100 – олигомеры. Свойства полимеров определяются строением и степенью полимеризации – числом элементарных звеньев. Полимеры бывают – неорганические, органические и элементорганические. По происхождению различают природные (белки, крахмал), модифицированные (дополнительно изменённые природные, например, резина) и синтетические. По характеру соединения элементарных звеньев: линейные, разветвлённые, трёхмерные сшитые и др. По отношению к нагреванию выделяют термопластичные и термореактивные.Органические полимеры.
nCH2=CH2 → (-CH2 – CH2- )n - полиэтилен.Полимеры могут находится в кристаллическом, жидкокристаллическом и аморфном состоянии.
Молекулы полимеров со стереорегулярной ориентацией при охлаждении образуют состояние, характерное дальним порядком расположения состав звеньев. (кристаллическое).
По отношению к t полимеры делятся на термопласт. (многократно размягчаются и твердеют при охлаждении) и термореактивные (у которых молекулы имеют пространственную сшитую структуру, вторично форму не приобретают после нагрева).
Отношение
числа распавшихся молекул на ионы к
общему числу молекул в растворе
называется степенью
диссоциации:
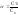 .
.
По склонности к диссоциации электролиты делятся на:
сильные
( )
и
слабые
(
)
и
слабые
(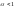 ).
).
К слабым электролитам относятся:
-
Органические кислоты (
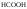 ,
,
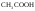 );
); -
Ряд неорганических кислот (
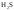 ,
,
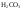 ,
,
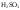 и др.);
и др.); -
Слабые основания (
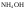 );
); -
Гидроксиды металлов (кроме 1-ой и 2-ой группы);
В растворах слабых электролитов одновременно присутствуют молекулы и ионы растворённого вещества, при этом между ними устанавливается динамическое равновесие:

В соответствии с законом действующих масс, константа равновесия:
 или
или
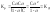
Константа равновесия
слабых электролитов называется
константой
диссоциации
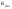 .
.
Закон разведения
Оствальда:
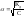 (
(
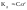 )
)
Закон Оствальда позволяет рассчитать степень диссоциации слабых электролитов при различных концентрациях, если известен коэффициент диссоциации (справочный).
Ковалентная связь – тип химической связи между атомами, возникающей при обобществлении электронов, которые принадлежат этим атомам
Метод молекулярных орбиталей предполагает, что при образовании ковалентной связи атомные орбитали образуют молекулярные орбитали. С позиции ММО каждый электрон принадлежит всей молекуле и движется в поле всех её ядер и электронов, т. е. находится на орбитали, охватывающей всю молекулу. Такая орбиталь называется молекулярной. Молекулярная орбиталь (МО) представляет собой линейную комбинацию атомных орбиталей: AB=A+B. При сложении волновых функций атомных орбиталей образуется связывающая молекулярная орбиталь. При вычитании образуется разрыхляющая молекулярная орбиталь. При переходе атомных орбиталей в связующую молекулярную орбиталь происходит уменьшение энергии, а при разрыхляющих – энергия увеличивается. Связывающая молекулярная орбиталь характеризуется повышением электронной плотности между двумя ядрами. Согласно ММО образование химического соединения возможно только тогда, когда число электронов на связывающей МО больше числа электронов на разрыхляющих.
При участии в
образовании -связей
орбиталей разных типов, например, в
молекуле
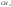 следовало бы ожидать формирование
связей, отличающихся друг от друга по
длине и прочности. Однако
следовало бы ожидать формирование
связей, отличающихся друг от друга по
длине и прочности. Однако
все
9
9
9
связи C − H равноценны и располагаются симметрично друг другу. В рамках МВС эти факты объясняются на основе концепции гибридизации атомных валентных орбиталей. Согласно ей в валентных состояниях электроны распределяются не на чистых S и P орбиталях, а на смешанных (гибридных). Число гибридных равно числу атомных орбиталей. Гибридные орбитали одинаковы по форме и энергии. В отличии от атомных орбиталей гибридные более вытянуты в направлении образования химической связи.
Типы гибридизаций:
SP3 – гибридизация – при взаимодействии 1S и 3P орбиталей,
SP2 – гибридизация – при взаимодействии 1S и 2P орбиталей,
SP – гибридизация – при взаимодействии 1S и 1P орбиталей
Металлы
IA
группы имеют серебристую окраску, но
быстро тускнеют на воздухе; мягкие;
низкая температура плавления и кипения;
малая плотность ( ,
,
 ,
,
 легче воды). Называются щелочными
металлами,
легче воды). Называются щелочными
металлами,
 и
и
 .
.
Химические свойства:
-
окисляются на воздухе:
 − оксид,
− оксид,
 − пероксид
− пероксид
 ,
,
 ,
,
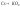 −
надпероксид, супероксид
−
надпероксид, супероксид
-
реагируют с водой
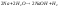
-
щелочные металлы реагируют с галогенами:
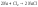
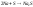
-
практически все S-элементы реагируют с жидким аммиаком, образуя амиды:
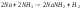
Металлы IIA группы имеют 2 валентных электрона; степень окисления +1, +2; энергия ионизации мала и в группе уменьшается сверху вниз.(Be,Mg,Ca,Sr,Ba,Ra)
Химические свойства:
1.реагируют
с водой за исключением
 и
и

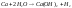
2. реагируют с жидким аммиаком, образуя нитриды:
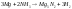
3.металлы группы IIA при высоких температурах реагируют с углеродом, образуя карбиды; важным карбидом является карбид кальция, он реагирует с водой, образуя ацетилен:
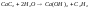
10
