
- •7. Правила заполнения электронами атомных орбиталей (принцип минимальной энергии, правило Клечковского, правила Паули и Гунда.)
- •Гидролиз солей: типы, константа и степень гидролиза.
- •Сильные (активность, коэффициент активности, ионная сила) электролиты.
- •Химические источники тока: гальванические элементы (эдс)
- •Пример - батарейка
- •Коррозия металлов: химическая
- •34. Понятие о комплексных соединениях: строение, номенклатура.
- •1.Основные законы и понятия в химии.
- •Константа воды. Водородный показатель (pH).
- •28. Окислительно-восстановительные реакции: степень окисления, окислитель и восстановитель (важнейшие окислители и восстановители), типы окислительно-восстановительных реакций.
- •Идеальные растворы. Растворы неэлектролитов: понятия диффузии и осмоса. Разбавленные и концентрированные растворы; насыщенный раствор.
- •2.Оксиды, типы оксидов. Методы получения, химические свойства, номенклатура основных, кислотных, амфотерных.
- •Буферные растворы.
-
34. Понятие о комплексных соединениях: строение, номенклатура.
Комплексные соединения – сложные соединения, состоящие из сильно взаимодействующих между собой группировок. Теория о свойствах и строении комплексных соединений принадлежит швейцарскому учёному Вернеру. Комплексные соединения состоят из внешней и внутренней сфер.
K2[Cu(CN)4]
-
↑ ↑
Внеш. Внутр.
Внутренняя сфера – комплекс, включающий центральный ион или атом, вокруг которого координируются “-, +” заряженные ионы или нейтральные молекулы. Внутренняя сфера заключается в скобки. [Zn(OH)4]+²; [Zn(NH3)4]-². Центральный ион или атом называется комплексообразователем, координирующие им ионы или молекулы – лиганды.
Число лигандов, координированных комплексообразователем – координационное число. В зависимости от заряда различают анионные комплексы [Al(OH)4]-, [Zn(CN)4]²-, катионные [Cu(NH3)4]²+ и нейтральные [Pt(NH3)2Cl2]
-
Нейтральные не имеют внешней среды.
Заряд комплекса = алгебраическая сумма заряда центрального иона и заряда лигандов Z[Al(OH)4]-=ZAl3++ 4ZOH-=3+(-4)=-1
Комплексообразователи – атомы или ионы, имеющие вакантные орбитали. Способность к комплексообразованию увеличивается с увеличением Z иона.
Лиганды – к числу лигандов относятся простые анионы F-, Cl-, B-, J-, S2- сложные анионы СN-, NCS-, NO2-, молекулы лигандов имеют неподеленные пары е.
В зависимости от того, какое число вакантных орбиталей у комплексообразователя занимают лиганды, они подразделяются на монодентантные (1 орбиталь) NH3; Cl-; бидентантные, например N2H4 полидентантные. (сколько σ-связей между лигандом комплексообразователем). Би-, полидентантные лиганды при взаимодействии с комплексообразователями образуют замкнутые циклы – (клешневидные) хелатные.
10
10
Обратимые и необратимые реакции. Химическое равновесие; константа равновесия, влияние температуры на константу равновесия. Принцип Ле-Шателье.
Реакции, которые протекают только в одном направлении и идут до конца – необратимые (образование осадка, выделение газа). Их мало.
Большинство реакций
– обратимые:
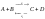 .
.
Согласно закону действия масс:

![]()
 – химическое
равновесие.
– химическое
равновесие.
Состояние системы,
в которой
 прямой реакции =
прямой реакции =
 обратной реакции, называется химическим
равновесием.
обратной реакции, называется химическим
равновесием.

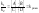
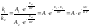
11
11
11
11
12
12
12
13
13
С
увеличением температуры,
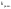 :
:
для эндотермической реакции возрастает
для экзотермической реакции убывает
для T = const остаётся постоянным
Влияние различных факторов на положение химического равновесия определяется принципом Ла-Шателье: если на систему, находящуюся в равновесии, оказать какое-либо воздействие, то в системе усиливаются процессы, стремящиеся уменьшить это воздействие.
В состоянии
равновесия
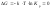 .
.
Химические
свойства элементов IIIA-подгруппы, их
оксидов
и гидроксидов:
Рассмотрим 3 группу B,
Al,
Ga,
In,
Tl
 ;
Tl:
степень окисления +1, у остальных +3. В
возбужденном состоянии
;
Tl:
степень окисления +1, у остальных +3. В
возбужденном состоянии
 - число не спаренных электронов
увеличивается. В группе сверху вниз
металлические свойства усиливаются,
если барий типичный неметалл, то In,
Tl-
типичные металлы.
- число не спаренных электронов
увеличивается. В группе сверху вниз
металлические свойства усиливаются,
если барий типичный неметалл, то In,
Tl-
типичные металлы.
Соединения
бора:
 борная кислота,
борная кислота,
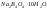 -
бура,
-
бура,
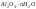 -
боксит,
-
боксит,
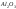 -
кристаллический корунд. Борная кислота
может быть получена
-
кристаллический корунд. Борная кислота
может быть получена
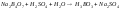 ,
,
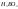 при t
не устойчива и разлагается на
при t
не устойчива и разлагается на
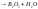 .
.
Бор
может быть получен из
 ,
Al
получают электролизом расплава
,
Al
получают электролизом расплава
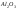 .
.
In, Tl, Ga получают из водных растворов солей электролизом.
C
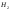 не взаимодействуют Al,
Ga,
In,
на воздухе покрываются оксидной пленкой.
не взаимодействуют Al,
Ga,
In,
на воздухе покрываются оксидной пленкой.
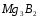 -
борид.
-
борид.
При гидролизе боридов образуется кислота
 \
\

Если
удалить оксидную пленку, то Al
взаимодействует с водой
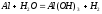
остальные
Ga,
In,
Tl
с
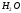 не взаимодействуют.
не взаимодействуют.
Алюминий
используется в металлургии, обладает
восстановительными свойствами
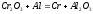 .
Отношение к кислотам: Барий c
разбавленными не реагирует, остальные
Al,
Ga,
In:
.
Отношение к кислотам: Барий c
разбавленными не реагирует, остальные
Al,
Ga,
In:
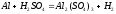 ,
,
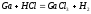 , Tl
с разбавленными не взаимодействует,
т.е. он покрывается нерастворимой
пленкой солей
, Tl
с разбавленными не взаимодействует,
т.е. он покрывается нерастворимой
пленкой солей
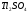
концентрированная серная и азотная окисляют барий до борной кислоты:
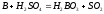 ;
;
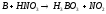
Al c концентрированной азотной кислотой не взаимодействуют Al, Ga, In растворяются в растворах щелочей.
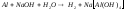 тетрагидроксоалюминат
Na
тетрагидроксоалюминат
Na
B
как неметалл взаимодействует с металлом
и образуется
 -
борид.
-
борид.
При гидролизе боридов образуется кислота

Если
удалить оксидную пленку, то Al
взаимодействует с водой

остальные
Ga,
In,
Tl
с
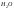 не взаимодействуют.
не взаимодействуют.
Алюминий
используется в металлургии, обладает
восстановительными свойствами
 .
Отношение к кислотам: Барий c
разбавленными не реагирует, остальные
Al,
Ga,
In:
.
Отношение к кислотам: Барий c
разбавленными не реагирует, остальные
Al,
Ga,
In:
 ,
,
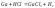 , Tl
с разбавленными не взаимодействует,
т.е. он покрывается нерастворимой
пленкой солей
, Tl
с разбавленными не взаимодействует,
т.е. он покрывается нерастворимой
пленкой солей
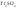
концентрированная серная и азотная окисляют барий до борной кислоты:

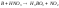
Al c концентрированной азотной кислотой не взаимодействуют Al, Ga, In растворяются в растворах щелочей.
 тетрагидроксоалюминат
Na
тетрагидроксоалюминат
Na
