
- •I курса по профилю подготовки «Биология»
- •Введение
- •Общие правила работы в химической лаборатории.
- •Оформление лабораторной работы и лабораторного журнала
- •Лабораторная работа №1 определение молярной массы эквивалента металла по количеству выделившегося водорода Теоретическая часть.
- •Выполнение работы
- •Контрольные вопросы
- •Лабораторная работа №2 взвешивание приготовление растворов. Титрование Теоретическая часть
- •Области перехода окраски некоторых рН-индикаторов
- •Выполнение работы
- •Контрольные вопросы
- •Лабораторная работа №3 скорость химических реакций Теоретическая часть
- •Выполнение работы
- •Контрольные вопросы
- •Лабораторная работа №4 буферные растворы. Буфетное действие Теоретическая часть
- •Расчет рН буферного раствора
- •Выполнение работы
- •Контрольные вопросы
- •Лабораторная работа №5 гидролиз Теоретическая часть
- •Выполнение работы
- •Контрольные вопросы
- •Лабораторная работа №6 окислительно-восстановительные реакци Теоретическая часть
- •Выполнение работы
- •Контрольные вопросы
- •Лабораторная работа №7 химия элементов. Сера. Фосфор. Азот Теоретическая часть
- •Выполнение работы
- •Сера. Соединния серы
- •Азот. Соединения азота
- •Фосфор. Соединения фосфора
- •Контрольные вопросы
- •Лабораторная работа №8 химия соединений d – элементов Теоретическая часть
- •Выполнение работы
- •Контрольные вопросы
- •Список рекомендуемой литературы
- •Содержание
Области перехода окраски некоторых рН-индикаторов
|
Индикатор |
Окраска кислотной формы |
Окраска щелочной формы |
Область перехода рН |
рТ |
|
Фенолфталеин |
Бесцветная |
Красная |
8,0-10,0 |
9,0 |
|
Лакмус |
Красная |
Синяя |
5,0-8,0 |
7,0 |
|
Метил-оранж |
Розовая |
Желтая |
3,1-4,4 |
4,0 |
|
Метил-красный |
Красная |
Желтая |
4,2-6,2 |
5,5 |
некоторого физического свойства. Часто используются органические красители, окраска которых изменяется по достижении конечной точки титрования (см. табл.1).
Расчет концентрации исследуемого раствора, в соответствии с законом эквивалентов, проводят по формуле:
Сэкв 1V1 = Сэкв 2V2, (7)
где Сэкв 1 и Сэкв 2 – молярные концентрации эквивалента пробы и титранта, соответственно, моль экв/л; V1 – отмеренный объем пробы, л; V2 – объем титранта, израсходованный на титрование, л.
При определении концентраций кислот и оснований используют метод кислотно-основного титрования, в основе которого лежит реакция нейтрализации:
Н+ + ОН Н2О.
В кислотной среде концентрация ионов водорода Н+ больше концентрации гидроксид-ионов ОН, а в щелочной среде, наоборот, меньше. Для удобства характеристики среды используют понятие водородного показателя рН, численно равного отрицательному десятичному логарифму молярной концентрации ионов водорода в растворе:
рН
= lg
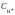 .
(8)
.
(8)
Поскольку в водных растворах произведение молярных концентраций ионов водорода и гидроксид-ионов:
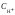
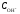 =
=
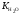 ,
(9)
,
(9)
называемое
ионным
произведением воды,
– величина постоянная и при Т=298К
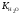 =1014,
в нейтральной среде рН = 7, в кислотной
рН
7, в щелочной рН
7.
=1014,
в нейтральной среде рН = 7, в кислотной
рН
7, в щелочной рН
7.
Истинная точка эквивалентности кислотно-основного титрования соответствует равенству молярных концентраций ионов водорода Н+ и гидроксид-ионов ОН:
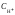 =
=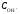 .
.
Реакция нейтрализации не сопровождается видимыми изменениями, например, переменой окраски раствора. Поэтому для фиксирования точки эквивалентности используют органические красители, структура и окраска которых зависит от величины водородного показателя рН [10].
Выполнение работы
Цель работы: изучение различных способов приготовления растворов заданной концентрации.
Меры предосторожности при выполнении работы:
1. Не касаться руками гранул щелочи! При взятии навески вещество отбирать только чистым шпателем.
2. Сливание и переливание растворов производить только с помощью воронок.
3. Погружение ареометра в раствор производить медленно, постепенно, придерживая его пальцем у стенки сосуда.
4. Вскрытие ампул фиксанала производить только с помощью фабричных бойков, защищая руки от возможных порезов с помощью полотенца.
5. Работать с твердой щелочью только в защитных очках и перчатках.
ОПЫТ 1. ОПРЕДЕЛЕНИЕ МАССОВОЙ ДОЛИ РАСТВОРЕННОГО ВЕЩЕСТВА ПО ОТНОСИТЕЛЬНОЙ ПЛОТНОСТИ РАСТВОРА
Получите задание у преподавателя: приготовить из кристаллического гидроксида натрия (NaOH) или калия (KOH) и воды определенное количество (мл) раствора заданной преподавателем концентрации.
Рассчитать необходимое для приготовления заданного раствора количество вещества гидроксида натрия (NaOH) или калия (KOH)) и растворителя воды.
Взвесить рассчитанное количество гидроксида натрия (NaOH) или калия (KOH) в предварительно взвешенном стакане на технических весах с точностью до 0,01 г. (Осторожно! Беречь глаза! Не касаться руками гранул щелочи! Вещество отбирать только чистым сухим шпателем!)
Мерным цилиндром отмерить необходимое количество воды, вылить воду в стакан и растворить в ней щелочь, осторожно перемешивая раствор стеклянной палочкой. Охладить раствор до температуры окружающей среды.
Определить плотность полученного раствора. Для этого в приготовленный сухой (или ополоснутый приготовленным раствором) цилиндр налить раствор, осторожно отпустить в него ареометр так, чтобы он не касался стенок цилиндра, не тонул (касался дна) и не всплывал. Деление шкалы ареометра, до которого он погрузился в раствор, покажет плотность раствора. Отсчет производится по нижнему краю мениска. Если ареометр всплывает, так что уровень жидкости не достигает его шкалы, то плотность раствора больше, чем указана на шкале ареометра. Если ареометр оказывается погруженным в раствор настолько, что уровень жидкости выше его шкалы, то плотность раствора будет меньше плотности, указанной на шкале, в обоих случаях следует переменить ареометра на более подходящий. После того, как отметили деление шкалы, соответствующее нижнему краю мениска жидкости в цилиндре, и произвели отсчет по шкале сверху вниз, ареометр следует осторожно вымыть, промыть дистиллированной водой, осторожно промокнуть и сдать лаборанту, после чего раствор из цилиндра вылить в приготовленную склянку. Сравнить полученную величину плотности раствора щелочи с табличной и определить массовую долю приготовленного раствора по таблице, исходя из экспериментальной величины плотности полученного раствора щелочи.
Если показания ареометра не совпадают с табличными данными, то массовую долю определяют методом интерполяции - определение промежуточного значения по двум крайним. Для этого проводят следующий расчет.
Допустим, при помощи ареометра определена плотность раствора щелочи 1,247 г/см3. Табличные значения плотности 1.241 г/см3 и 1,263 г/см3 соответствуют массовой доле 22 % и 24 %. Таким образом, изменению массовой доли, соответствует изменение плотности на 1.263 - 1.241 = 0.022 единиц. Плотность приготовленного нами раствора отличается от 1,241 на величину 1.247 - 1,241 = 0,006. Считая, что в указанных пределах между плотностью и массовой долей раствора зависимость линейная, составляют пропорцию:
0.022 – 2 %. 0.006 - X X = 0. З %.
Следовательно, массовая доля щелочи в растворе 22 % + 0,3 % = 22,3 %.
Примечание. Обычно ареометры калибруют для 20 ºС, для этой же температуры приводятся данные в таблицах плотностей растворов. Однако, если не требуется особой точности, табличными данными пользуются и когда плотность определена при других температурах.
ОПЫТ 2. ОПРЕДЕЛЕНИЕ МОЛЯРНОЙ КОНЦЕНТРАЦИИ ЭКВИВАЛЕНТА И УСТАНОВКА ТИТРА ПРИГОТОВЛЕННОГО РАСТВОРА ЩЕЛОЧИ
Определить точную концентрацию приготовленного раствора щелочи путем титрования его раствором кислоты с точно известной концентрацией. Для проведения титрования необходимо выполнить следующее: бюретку заполняют до нулевой отметки (нижний край мениска!) раствором кислоты, следя за тем, чтобы носик бюретки был также полностью заполнен (не должно быть пузырьков воздуха). Затем пипетку ополаскивают приготовленным ранее и подлежащим анализу раствором щелочи, готовят две три конические колбы, предназначенные для титрования. Затем пипеткой отобрать с помощью резиновой груши точный объем (равный объему пипетки - нижний мениск!) анализируемого раствора щелочи и перенести в коническую колбу для титрования. Последние капли из кончика пипетки удалить, коснувшись кончиком пипетки стенки колбы, но не выдувать! Прибавить в колбу для титрования 2-3 капли индикатора метилового оранжевого. Какую окраску приобретает раствор? Колбу с раствором поставить на лист белой бумаги и расположить под бюреткой так, чтобы ее носик был погружен в колбу приблизительно на 1 см. Рядом поставить колбу с раствором сравнения: в аналогичную коническую колбу прилить равный объем дистиллированной воды и прибавить 2-3 капли индикатора метилового оранжевого. Операцию титрования выполняют следующим образом: левой рукой по каплям прибавляют из бюретки раствор кислоты в колбу с раствором щелочи, постоянно перемешивая содержимое колбы плавным круговым движениями правой руки, держа колбу за горлышко. Внимательно наблюдают за изменением окраски раствора после каждой прибавленной капли кислоты. Конец титрования определяют по резкому изменению окраски исследуемого раствора от одной капли, после чего по шкале бюретки с точностью до 1 мл устанавливают количество (объем) кислоты, затраченной на реакцию со щелочью.
Титрование повторяют не менее трех раз, проводя параллельные опыты. Результат первого титрования считают ориентировочным и при существенном расхождении с последующими его можно не принимать во внимание при расчетах. При последующих титрованиях кислоту из бюретки можно прибавлять быстрее, и лишь последний миллиметр прибавляют медленно, по каплям, не переставая перемешивать содержимое колбы, пока от прибавленной одной капли не произойдет изменение окраски раствора. Окраску раствора в точке конца титрования сравнивают с окраской раствора сравнения.
Объем раствора кислоты, затраченный на реакцию со щелочью, отсчитывают по нижнему мениску с точностью до 0,05 мл. Полученные данные, которые не должны различаться между собой более, чем на 0,1 мл. При большом расхождении полученных данных титрование повторить!
Рассчитать молярную концентрацию эквивалента, а также массовую долю приготовленного раствора щелочи.
