
- •I курса по профилю подготовки «Биология»
- •Введение
- •Общие правила работы в химической лаборатории.
- •Оформление лабораторной работы и лабораторного журнала
- •Лабораторная работа №1 определение молярной массы эквивалента металла по количеству выделившегося водорода Теоретическая часть.
- •Выполнение работы
- •Контрольные вопросы
- •Лабораторная работа №2 взвешивание приготовление растворов. Титрование Теоретическая часть
- •Области перехода окраски некоторых рН-индикаторов
- •Выполнение работы
- •Контрольные вопросы
- •Лабораторная работа №3 скорость химических реакций Теоретическая часть
- •Выполнение работы
- •Контрольные вопросы
- •Лабораторная работа №4 буферные растворы. Буфетное действие Теоретическая часть
- •Расчет рН буферного раствора
- •Выполнение работы
- •Контрольные вопросы
- •Лабораторная работа №5 гидролиз Теоретическая часть
- •Выполнение работы
- •Контрольные вопросы
- •Лабораторная работа №6 окислительно-восстановительные реакци Теоретическая часть
- •Выполнение работы
- •Контрольные вопросы
- •Лабораторная работа №7 химия элементов. Сера. Фосфор. Азот Теоретическая часть
- •Выполнение работы
- •Сера. Соединния серы
- •Азот. Соединения азота
- •Фосфор. Соединения фосфора
- •Контрольные вопросы
- •Лабораторная работа №8 химия соединений d – элементов Теоретическая часть
- •Выполнение работы
- •Контрольные вопросы
- •Список рекомендуемой литературы
- •Содержание
Контрольные вопросы
1. Определить молярный объем эквивалента: Н2; О2; С12.
2. Почему объем выделившегося водорода в реакции металла с кислотой в данной работе надо приводить к нормальным условиям?
3. Рассчитайте молярную массу эквивалента перманганата калия (KMnO4), рассматривая данное соединение как:
а) соль;
б) окислитель, превращающийся в MnO(OH)2;
в) окислитель, превращающийся в MnSO4.
4. Рассчитать молярную массу эквивалента
|
№ |
Элемент |
Соединение |
Ион |
|
1 |
Li |
MnO(OH)2 |
SO32- |
|
2 |
Al |
CrO3 |
ClO4- |
|
3 |
Ba |
Al2(SO4)3 |
UO2+ |
|
4 |
Si |
Mn2O7 |
PO43- |
|
5 |
Na |
Cr2O3 |
[PtCl6]2- |
|
|
|
|
|
5. Какой объем занимает при нормальных условиях 1 моль эквивалента газообразного вещества: а) кислорода, б) хлора; в) углекислого газа?
6. Используя закон эквивалентов, рассчитайте объем оксида углерода (II), который потребуется для восстановления железа из 1 кг оксида железа (III) при нормальных условиях.
Лабораторная работа №2 взвешивание приготовление растворов. Титрование Теоретическая часть
Растворы это гомогенные (состоящие из одной фазы) системы, содержащие несколько компонентов. Растворы бывают газообразные, жидкие и твердые. Среди соединений (компонентов), образовавших раствор, выделяют растворенные вещества и растворитель.
Растворителем принято считать компонент, агрегатное состояние которого соответствует агрегатному состоянию раствора. Как правило, это компонент, содержание которого в растворе выше содержания остальных, называемых растворенными веществами. Наибольшее практическое значение имеют жидкие растворы, в частности – водные растворы, в которых растворителем является вода.
Растворимостью называется способность вещества растворяться в том или ином растворителе. Мерой растворимости вещества является его содержание в насыщенном растворе. Состав раствора и содержание растворенного вещества (концентрация) выражаются различными способами.
1. Массовая доля компонента i это отношение массы i-го компонента mi к массе раствора mi:
i = mi / mi , (1)
i безразмерная величина, принимающая значения от 0 до 1 или от 0 до 100% (в последнем случае говорят о процентной концентрации по массе).
2. Молярная доля компонента Хi это отношение числа молей i-го компонента ni к сумме молей ni всех компонентов, образующих раствор, безразмерная величина:
Хi = ni / ni . (2)
3. Моляльная концентрация растворенного вещества, или моляльность, Сm число молей растворенного вещества n, приходящихся на 1 кг растворителя, моль/кг:
Сm
= n
/ ms
=
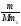 ,
(3)
,
(3)
где m – масса растворенного вещества (г); М – молярная масса растворенного вещества (г/моль); ms масса растворителя (кг).
4. Молярная концентрация растворенного вещества, или молярность, С число молей растворенного вещества n в 1 л раствора, моль/л, или, сокращенно, М:
С
= n
/ V
=
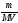 ,
(4)
,
(4)
где V объем раствора (л); m – масса растворенного вещества (г); М – молярная масса растворенного вещества (г/моль).
5. Молярная концентрация эквивалента растворенного вещества, или нормальная концентрация, или нормальность, Сэкв число молей эквивалентов растворенного вещества nэкв в 1 л раствора, моль экв/л, или, сокращенно, н.:
Сэкв=
nэкв
/ V
=
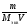 =
=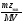 ,
(5)
,
(5)
где Мэкв – молярная масса эквивалента растворенного вещества (г/моль экв); zэкв – число эквивалентности растворенного вещества; V объем раствора (л); m – масса растворенного вещества (г); М – молярная масса растворенного вещества (г/моль).
6. Массовая концентрация Смасс – масса растворенного вещества m в 1 л раствора, г/л:
Смасс = m / V , (6)
где V объем раствора (л).
7. Титр Т – масса растворенного вещества в 1 мл раствора, г/мл.
Т=Смасс/1000
Установление состава раствора является одной из задач аналитической химии. Количественный анализ проводят физическими, химическими и физико-химическими методами. Одним из наиболее простых среди них является титриметрия.
Титриметрия – аналитический метод, основанный на измерении объема раствора реагента точно известной концентрации, взаимодействующего с определяемым веществом. Растворы реагентов известной концентрации, используемые в титриметрии, называют титрованными (стандартными) растворами, или титрантами.
Принцип титрования: к раствору анализируемого вещества неизвестной концентрации (пробе) добавляют небольшими порциями раствор титранта до тех пор, пока не будет получен сигнал индикатора, свидетельствующий о прекращении реакции (достижении конечной точки титрования). Момент окончания титрования можно установить при помощи химической реакции или по изменению
Таблица 1
