
Andreyanov ON
.pdfкислотностью желудочного сока, для улучшения переваривания пищи (М.Д.
Машковский, 2008). Поэтому мы отказались его тестировать на аппаратах типа
АВТ.
Таблица 42 – Протеолитическая активность ИЖС с использованием разных пепсинов при классическом пассивном методе переваривания 16-18
часов (по Ю.А. Березанцеву)
Показатели |
|
Наименование фирм пепсинов |
|||
Акрос |
Сигма |
Шако |
Ацидин-Пепсин |
||
|
|||||
Охлажденная мышечная ткань (свинина) |
|
||||
Процент |
93,4±2,7 |
81,7±1,9 |
80,9±0,8 |
11,3±0,4 |
|
перевариваемости, % |
|||||
|
|
|
|
||
Выделение личинок |
++++ |
++++ |
+++ |
+ |
|
Охлажденная мышечная ткань (мясо лабораторных крыс) |
|||||
Процент |
96,3±1,3 |
85,8±0,5 |
81,4±1,8 |
14,6±2,6 |
|
перевариваемости, % |
|||||
|
|
|
|
||
Выделение личинок |
++++ |
++++ |
+++ |
+ |
|
Свинина технологической обработки (горячего копчения) |
|||||
Процент |
86,6±2,1 |
74,8±0,4 |
69,6±0,7 |
10,5±1,1 |
|
перевариваемости, % |
|||||
|
|
|
|
||
Выделение личинок |
++++ |
++++ |
+++ |
+ |
|
При постановке опыта на аппарате по выделению личинок трихинелл
«Гельми» дополнительно использовали свиной биохимический препарат фирмы Meрк (Германия) с активностью >= 0,7 Ph.Eur.U/mg, как у пепсина фирмы Акрос.
При проведении автоматизированного аппаратного пептолиза в 2 циклах
(по 35 минут каждый) с использованием разных видов пепсинов были получены иные результаты. После первого цикла переваривания охлажденного мяса на аппарате «Гельми» наилучшей протеолитической способностью обладал ИЖС, приготовленный из пепсина фирмы Акрос, – 48,1%, далее в порядке убывания из препарата фирмы Сигма – 36,0%, из пепсина фирмы Мерк
–28,3% и российский Шако – 17,0%. Выделение личинок трихинелл было аналогичным. При исследовании копченой свинины эффективность пепсинов,
Таблица 43 – Протеолитическая эффективность ИЖС с использованием разных пепсинов при автоматизированном пептолизе на аппарате «Гельми»
Показатели |
|
Наименование фирм пепсинов |
|
|||
Сигма |
Акрос |
Meрк |
|
Шако |
||
|
|
|||||
|
1 цикл – 35 минут |
|
|
|
||
Охлажденная мышечная ткань (мясо лабораторных крыс) |
||||||
Процент |
36,0±0,1 |
48,1±1,5 |
28,3±0,5 |
|
17,0±0,2 |
|
перевариваемости, % |
|
|||||
|
|
|
|
|
||
Выделение личинок |
++++ |
++++ |
+++ |
|
++ |
|
Свинина технологической обработки (горячее копчение) |
|
|||||
Процент |
Происходит набухание мышечной ткани |
|||||
перевариваемости, % |
||||||
|
|
|
|
|
||
Выделение личинок |
++ |
++++ |
++ |
|
+ |
|
|
2 цикл - 35 минут |
|
|
|
||
Охлажденная мышечная ткань (мясо лабораторных крыс) |
|
|||||
Процент |
69,4±1,1 |
78,0±0,7 |
57,7±0,5 |
|
40,0±1,0 |
|
перевариваемости, % |
|
|||||
|
|
|
|
|
||
Выделение личинок |
+++ |
+++ |
++ |
|
++++ |
|
Свинина технологической обработки (горячее копчение) |
|
|||||
Процент |
49,0±2,1 |
52,1±1,3 |
45,0±0,2 |
|
9,2±0,3 |
|
перевариваемости, % |
|
|||||
|
|
|
|
|
||
Выделение личинок |
++++ |
++++ |
+++ |
|
++++ |
|
растворенных в кислой воде, не удалось выявить, так как произошло насыщение технологически обработанного мяса желудочным соком. Навески мясного фарша (50 грамм) стали весить от 56,5 до 59,0 грамм после отключения прибора. Только навеска, которую поместили в ИЖС с препаратом фирмы Акрос, осталась на прежнем уровне – 50,0 грамм. Наибольшее количество личинок трихинелл из копченой свинины выделилось в ИЖС с пепсином фирмы Акрос, в 4-5 раз меньше - в ИЖС с немецкими пепсинами, наименьшее количество отмечено в пробе с использованием отечественного препарата.
После проведения второго цикла активного переваривания охлажденной мышечной ткани была отмечена высокая ферментная активность ИЖС с использованием препарата фирмы Акрос – 78,0%, несколько хуже - у
192
препаратов фирмы Сигма – 69,4% и Мерк – 57,7%. Наименьшая активность отмечена у свиного пепсина Шако – 40,0%. Однако выделение личинок трихинелл из мышечной ткани было другим. Больше всего личинок выпало в ИЖС, приготовленный с препаратом фирмы Шако, меньше всего личинок оказалось в осадке с пепсином фирмы Мерк. Средний показатель выделения личинок трихинелл отмечен у соков на основе пепсинов фирм Акрос и Сигма.
При искусственном пептолизе копченой свинины высокой ферментной активностью обладал препарат фирмы Акрос, несколько меньшая активность отмечена у пепсинов фирм Сигма и Мерк. В 5 и более раз хуже лизировал мышечную ткань препарат фирмы Шако. Активное выделение жизнеспособных и мертвых личинок трихинелл, а также личинок в капсулах отмечено в рецептурах всех препаратов. Несколько меньше их выпало в ИЖС с использованием ферментного препарата фирмы Мерк.
Широко применяемый метод компрессорной трихинеллоскопии, как правило, ориентирован на исследование отдельных образцов и практически не эффективен для экспертизы крупных партий мясной продукции. В отличие от него автоматизированный метод трихинеллоскопии с использованием специальных приборов типа АВТ совмещает основные процессы, связанные с перевариванием мышечной ткани и выделением личинок трихинелл, и имеет высокую производительность. Данный метод широко применяется в ветеринарно-санитарной экспертизе на мясоперерабатывающих предприятиях и ветеринарных лабораториях.
Метод исследования (пептолиз) основан на растворении в ИЖС мышечной ткани и обнаружении в осадке личинок трихинелл. Метод позволяет выделить личинки гельминтов даже при слабой инвазии, что не всегда удается при обычном компрессорном исследовании. Это наиболее точный метод, его проведение регламентировано «Методикой лабораторной диагностики трихинеллеза», утвержденной Главным управлением ветеринарии Госагропрома СССР 16.10.1986 г.
193
Таким образом, при проведении биохимического исследования охлажденного и копченого мяса на трихинеллез по классической методике переваривания (по Ю.А. Березанцеву) для приготовления ИЖС следует использовать протеолитические препараты (свиные пепсины) фирм Акрос
(Бельгия) и Сигма (Германия). Медицинский препарат Ацидин-Пепсин
(Республика Беларусь) из-за слабой протеолитической активности не подходит для трихинеллоскопического исследования мяса. При автоматизированном пептолизе на аппарате для выделения личинок трихинелл «Гельми» следует использовать пепсины фирм Акрос, Сигма, Мерк, предназначенные для биохимии. При тестировании пепсинов в составе ИЖС на копченых мясных изделиях с использованием аппарата «Гельми» необходимо проводить исследования в 2 цикла из-за набухания продуктов в первом цикле работы.
5.2. Дифференциальная диагностика трихинеллеза
Одной из задач настоящей работы было дифференцировать личинок трихинелл от ларвальных стадий развития личинок других гельминтов в мышечной ткани кабанов и других диких животных, используя методы компрессорной трихинеллоскопии и пептолиза (О.Н. Андреянов, 2013д).
В ходе наших исследований у плотоядных животных был выявлен возбудитель капсульного трихинеллеза Trichinella spр. в 20,9% случаев (табл.
44). Личинками трихинелл были заражены лисицы (ЭИ - 19,1%), волк (ЭИ - 14,3%), енотовидная собака (ЭИ - 14,8%), лесная (ЭИ - 31,6%) и каменная куницы (ЭИ - 33,3%), барсук (ЭИ - 12,5%). Интенсивность инвазии колебалась от 2 до 63 личинок в 1 грамме мышечной массы.
В мышечной ткани 2 кабанов и 1 горностая обнаружили личинки трематоды Alaria spр. (ЭИ соответственно 7,4% и 14,2% при ИИ в 1 грамме 1 –
8 лич.). У кабанов возрастом 3 – 4 лет они локализовались в диафрагме,
массетере, межреберных и икроножных мышцах, а у молодого горностая – только в диафрагме и межреберных мышцах. Проведение биологической пробы
194
на 2 беспородных щенках, возрастом 1 месяц, подтвердило пероральное инвазирование аляриями. При копроовоскопии фекалий методом последовательных промываний и на вскрытии тонкого отдела кишечника животного через 60 суток после скармливания мяса кабана у 1 животного были выявлены яйца трематодного типа и обнаружены 3 половозрелые трематоды
Alaria spр. (рис. 42 и 43).
Таблица 44 - Инвазированность мышечной ткани диких животных личинками гельминтов
|
|
|
ИИ, |
|
|
Гельминт |
Хозяин гельминта |
ЭИ, % |
лич. в г |
Место локализации |
|
|
|
|
мышц |
|
|
|
Лисица |
19,1 |
2-44 |
|
|
|
обыкновенная |
|
|||
|
|
|
|
||
|
Волк |
14,3 |
12 |
Вся |
|
Trichinella spр. |
Собака |
14,8 |
4-39 |
поперечнополосатая |
|
енотовидная |
мускулатура тушки и |
||||
|
|
|
|||
|
Куница лесная |
31,6 |
8-52 |
подкожная клетчатка |
|
|
Куница каменная |
33,3 |
11-63 |
шкур |
|
|
Барсук |
12,5 |
38 |
|
|
Среднее значение: |
20,93 |
2-63 |
|
||
|
Кабан |
7,4 |
1-8 |
Диафрагма, |
|
|
межреберные мышцы, |
||||
Alaria spр. |
|
|
|
||
|
|
|
|||
|
|
|
массетер, икроножная |
||
|
Горностай |
14,2 |
3 |
||
|
группа мышц |
||||
|
|
|
|
||
larva migrans |
Кабан |
11,1 |
1-5 |
Диафрагма, |
|
межреберные мышцы |
|||||
|
|
|
|
||
У 3 кабанов в межмышечной ткани диафрагмы и межреберных мышцах зарегистрировали личинок нематод аскаридного типа, ЭИ - 11,1%, ИИ - 1-5 лич.
в 1 грамме мышечной ткани. Биологическую пробу провели на белых беспородных крысятах массой 42 и 47 грамм возрастом 1 месяц. Выделенных после переваривания и многократного отмывания личинок ввели per os
животным в дозе 5 и 12 личинок на голову. Через 45 суток после заражения животных усыпили, а внутренние органы и тушки исследовали в аппарате
195

Бермана на наличие личинок нематод. В результате опыта личинок нематод не выявили.
Рисунок 42. Яйца трематод в фекалиях |
Рисунок 43. Трематоды Alaria spр. в |
|
тонком отделе кишечника щенка. |
||
щенка. Увеличение х80 (оригинал) |
||
Увеличение х15 (оригинал) |
||
|
Капсулы с трихинеллами необходимо отличать от капсул с личинками алярий (мезоцеркарий) и других нематод, которые также часто встречаются в образцах мышц диких животных. Дифференциация личинок основывается на морфологии возбудителей (табл. 45).
При этом личинки трихинелл таких наиболее распространенных видов, как
T. spiralis, T. nativа и других, образуют капсулы в мышечных волокнах поперечнополосатой мускулатуры. Личинки T. pseudospiralis не образуют капсулы и свободно лежат между мышечными волокнами. Личинки алярий также находятся в капсулах, которые располагаются между мышечными волокнами (Ю.Ф. Петров и др., 2008; А.В. Трусова, 2009).
При компрессорной диагностике в срезах мышц были отчетливо видны слоистые капсулы с трихинеллами, расположенные внутри мышечного волокна. В стенке капсулы хорошо видны внутренний гиалиновый и внешний утолщенный соединительнотканный слои. Капсулы имеют различную форму
(лимоновидную, овальную, круглую) и размеры с хорошо различимой
196

свернутой личинкой (или несколькими личинками) в виде объемной спирали
(рис. 44).
Таблица 45 - Дифференцированные признаки гельминтов, обнаруженных в образцах мышечной ткани животных (компрессорная трихинеллоскопия)
Показатель |
|
Класс гельминтов |
|
|
(признаки) |
нематода |
трематода |
нематода |
|
|
Trichinella spр. |
Alaria spр. |
Larva migrans |
|
Вид гельминта |
(изолят от |
(изолят от |
(изолят от |
|
|
лисицы) |
кабана) |
кабана) |
|
Наличие капсулы |
+ |
+ |
– |
|
|
В мышечном |
Между |
Между |
|
Локализация |
мышечными |
мышечными |
||
волокне |
||||
|
волокнами |
волокнами |
||
|
|
|||
Форма капсулы |
Овальная, |
Овальная |
– |
|
округлая |
||||
|
|
|
||
Размер капсулы, |
346±7,7 – |
|
|
|
мкм |
648,2±25,5 |
– |
||
387±5,89 |
||||
(n=25) |
|
|
||
|
|
|
||
Размер гельминта, |
1128±18,2 – |
662,4±20,1 – |
1454±38,2 – |
|
мкм (n=25) |
38,6±0,79 |
208,0±16,59 |
89,7±0,76 |
|
Наличие присосок |
– |
+ |
– |
Примечание: n – количество измерений.
a b
Рисунок 44. Возбудитель капсульного трихинеллеза Trichinella spр.: a – личинки трихинелл в диафрагмe лисицы; b – личинка трихинелл после пептолиза (оригинал)
197
Редко в образцах мышц обнаруживали капсулы темного цвета и с нечеткими очертаниями, в которых находили погибших или лизированных личинок трихинелл.
На 13 – 17-й день после заражения животных в мышечных волокнах могут встречаться юные и молодые личинки капсульных видов трихинелл, которые только начинают формировать соединительнотканную капсулу. Они очень подвижны, но мало заметны на срезе.
Личинки бескапсульного вида трихинелл также плохо видны на срезах, так как располагаются между мышечными волокнами. Они обычно свернуты в виде скрепки или полураскрытой скрепки. Однако, через некоторое время в тканевой жидкости свежих образцов мышц около среза можно наблюдать активно двигающихся трихинелл, которые сворачиваются в двойную спираль.
Поэтому для подтверждения диагноза на трихинеллез необходимо проводить пептолиз образца мышечной ткани.
Капсулы алярий обычно расположены между мышечными волокнами в тех же группах мышц поперечнополосатой мускулатуры, что и капсулы трихинелл,
но чаще на границе с жировой тканью. Капсула или мезоциста алярий более крупная, округлая и прозрачная, меняющая свою форму при движении личинки. Внутри нее видна активная плоская личинка с двумя присосками
(ротовой и брюшной) и У-образным кишечником. В нашем случае мезоцеркарии трематод были окружены прозрачной гиалиновой капсулой,
сформированной тканью хозяина (рис. 45).
Б.В. Ромашов с соавторами (2006) отмечают отсутствие соединительнотканной капсулы вокруг мезоцеркарий трематод, так как личинки алярий локализуется в межмышечном волокне мышечной ткани животного. Такие отличия, возможно, связаны с местом локализации и периодом нахождения трематод в мышцах, физиологическим состоянием самого возбудителя и другими факторами.
198
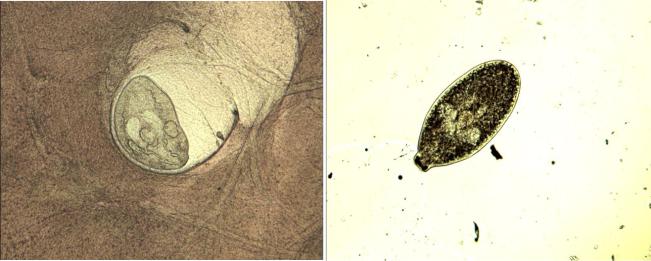
а b
Рисунок 45. Личиночная стадия Alaria spр.: a – личинка трематоды в мышечной ткани диафрагмы кабана; b – личинка трематоды после пептолиза (оригинал)
Личинки нематод аскаридного типа (larva migrans) свободно лежат в межмышечной ткани диафрагмы и межреберных мышцах кабанов, они не образуют капсул, не имеют хитиновых выростов вокруг ротового отверстия, не вооружены шипиками на хвостовом конце в отличие от личинок нематод спирурид Physocephalus sexalatus и Spirocerca lupi (Б.В. Ромашов и др., 2006).
На срезе они неподвижны и расположены в виде полураскрытой запятой,
латинской буквы S, скрепки или полукруга. Линейный размер личинок larva migrans в 1,5 раза больше, чем размер бескапсульных личинок трихинелл. При микроскопии виден простой мышечный пищевод, в то время как у спирурид он отчетливо разделен на железистую и мышечную части, а у трихинелл на переднем конце имеется хорошо выраженная стихосома, состоящая из стихоцитов.
При слабой интенсивности заражения животных паразитическими личинками эффективность компрессорной микроскопии значительно снижается. В этих случаях увеличивают число срезов мышц, исследуют другие группы мышц или используют метод переваривания в ИЖС. При пептолизе
199
мышечных волокон на аппарате «Гельми» личинки трихинелл появляются в осадке в течение 15 – 20 минут. Они активно двигаются, сгибаются и разгибаются, сворачиваются в спираль.
Активно двигающихся мезоцеркариев алярий мы обнаружили в осадке через 35 минут. Под микроскопом на плоском теле личинки были видны ротовая и брюшная присоски и У-образный кишечник. При использовании классического метода переваривания в ИЖС мезоцеркарии алярий погибли в осадке в течение 16 – 18 часов.
Личинки неизвестных нематод после пептолиза выпали в осадок искусственного сока и были жизнеспособными и слабоподвижными до 24
часов. При этом в отличие от личинок трихинелл не скручивались в спираль
(рис. 46).
На практике, при обнаружении личинок трихинелл, алярий и личинок неизвестных нематод в исследуемом материале, его необходимо направлять в ветеринарную лабораторию для дифференциальной диагностики, а тушу и органы изолировать.
Послеубойная ветеринарно-санитарная оценка мяса кабана для обнаружения личиночных форм гельминтов актуальна для государственных ветеринарно-санитарных инспекторов рынков и лабораторий. В настоящее время зарубежным и отечественным санитарным службам интересны вопросы оптимизации, разработки и официального введения в практику метода диагностики мышечного аляриоза (мезоцеркариоза). До сих пор не определен ветеринарно-санитарный подход при обнаружении личинок нематод с диагнозом larva migrans. Беспокойство как ветеринарных врачей, так и медиков основано на случае, повлекшем смерть человека от возбудителя мезоцеркариоза Alaria americana в Канаде (K. Mohl et al., 2009).
Представители дикой фауны являются резервуарами и переносчиками инвазионных болезней животных и человека. Влияние на природу, оказываемое деятельностью человека при освоении природных ресурсов, приводит к
200
